
Effet de la température sur la germination, la dégradation des réserves protéiques et minérales des graines du gombo (Abelmoschus esculentus L.)
B. Ben Dkhil *
M. Denden
Laboratoire d’Agronomie, Institut Supérieur Agronomique de Chott-Mariém 4042 Sousse.
Abstract - In order to study the physiological and biochemical responses of okra seed germination (Abelmoschus esculentus) during time under three temperature regimes (10, 25 and 40°C), an experiment was carried out on laboratory in a dark condition. Temperature effects on germination are studied in relation with water absorption, the degradation and mobilization of stored proteins and mineral reserves. Results indicated that 25°C was the optimal temperature that favorises a good aptitude to germinate, whereas low (10°C) and high temperatures (40°C) inhibited germination. Low temperature (10°C) slowed the rate of imbibition, increased proteins content and protease activity. Thermal inhibition of germination at 40°C is the consequence of a decrease on protease activity and toxicity due to sodium accumulation.
Key words: germination / temperature / Abelmoschus esculentus / stored proteins / protease / minerals reserves
Résumé - L’effet de la température sur la germination des graines du gombo (Abelmoschus esculentus L.) est étudié en relation avec la quantité d’eau absorbée, la mobilisation et la dégradation des réserves protéiques et l’utilisation des éléments potassium, sodium et calcium. Les résultats obtenus ont montré que le gombo est sensible à une variation de température, la germination est optimale à 25°C et elle est totalement inhibée à 10 et 40°C. Une basse température de 10°C a stimulé une augmentation de la teneur en protéines et de l’activité protéasique au niveau de l’embryon. L’inhibition de la germination à 40°C est la conséquence d’une inhibition de l’activité protéasique au niveau des cotylédons et d’une toxicité de l’embryon par l’élément sodium.
Mots clés : germination / température / Abelmoschus esculentus / réserves protéiques / protéases / réserves minérales
1. Introduction
La germination est une phase physiologique pendant laquelle la graine passe de l’état de vie ralentie à l’état de vie active (Caboche et al.1998). Elle est définie comme la somme des évènements qui conduisent la graine sèche à germer : cela commence par l’étape cruciale d’absorption de l’eau par la graine (Othman 2005), se termine par l’allongement de l’axe embryonnaire et l’émergence de la radicule à travers les structures qui entourent l’embryon (Shereena and Nabeesa 2006).
La germination des graines nécessite la mobilisation des réserves accumulées au cours de la maturation dont leur dégradation apportera l’énergie nécessaire à la croissance de la plantule. Cette mobilisation est la résultante des activités hydrolytiques qui libèrent les nutriments à partir des tissus de réserve, d’une part, et des mécanismes de leur transport vers les tissus embryonnaires, d’autre part (Mihoub et al. 2005). Selon les espèces, ces réserves peuvent être majoritairement de nature glucidique, lipidique et/ou protéique (Khemiri et al. 2004).
La respiration, l’hydrolyse des réserves et les activités enzymatiques demeurent sous la dépendance de la température. En effet, toute variation de la température d’incubation peut affecter en plus de l’activité de certaines enzymes, certains processus indispensables pour le contrôle de la germination comme la perméabilité membranaire et l’extensibilité de la paroi (Bewley and Black 1992; Gul and Waber 1999). Hawker and Jenner (1993) suggèrent que les hautes températures inhibent la germination des graines en limitant la disponibilité d’énergie et des hydrolysats, évènement conséquent d’un retard et d’une inhibition de la synthèse et/ou l’activité des enzymes hydrolytiques. De même, les basses températures entraînent une perturbation et un retard de coordination lors de la mobilisation des réserves (Nykiforuk and Johnson-Flanagan 1994).
Le gombo, autrefois rattaché au genre Hibiscus, constitue aujourd’hui le genre Abelmoschus, au sein de la famille des malvacées. L’espèce cultivée, Abelmoschus esculentus est une plante herbacée robuste, fibreuse, elle se caractérise par une croissance indéterminée (Hussain et al. 2006). Les tiges sont cylindriques plus ou moins fortement ramifiées glabrescentes avec des poils raides disséminés de 0.5 à 4 m de hauteur. Les ramifications sont dressées à courbées vers le bas. Les feuilles sont disposées en spirale, simples de forme et de taille variables. Elles sont grandes, longuement pétiolées palmatilobées ou palmatifides (Kesavan 1985). Les fleurs sont hermaphrodites, solitaires. Le fruit du gombo est une capsule pluriloculaire, sa croissance est très rapide puisqu’il peut atteindre 5 cm de long, 3 jours après la floraison, et c’est le stade de récolte le plus fréquent pour la consommation en frais. Sa taille peut varier, la longueur allant de 5 à 25 cm et la largeur de 1 à 5 cm.
En Tunisie, la superficie emblavée à la culture du gombo est de 188 ha, la zone de production se situe essentiellement dans les régions de Tunis, Bizerte, Béja et Gafsa, la production nationale a atteint 560 tonnes en 2010 (Ministère de l’agriculture, 2010). Certes, il existe des obstacles qui entravent le développement du gombo et qui limitent son extension dans le centre du pays. En effet, la sensibilité de cette espèce durant le stade germinatif est largement évoquée, elle est généralement attribuée à une imperméabilité des téguments qui s’oppose à la pénétration de l’eau et aux échanges gazeux (Demir 2001). En plus de ce facteur biotique, s’ajoutent les facteurs abiotiques comme la température et la salinité. Albregts and Howard (1973) ont suggéré la sensibilité du gombo à la salinité et son exigence en chaleur. Il est admis aussi qu’une exposition des graines du gombo à des températures hors de leur température optimale de germination peut entraîner l’entrée en dormance secondaire. Les agriculteurs pratiquent généralement le semis direct des graines, une telle pratique peut aggraver la situation au point où il serait difficile de contrôler les conditions adéquates pour réussir la germination et la levée des plantules.
L’importance est accordée dans le présent travail à la température, un facteur majeur et inhibiteur de la germination. Le choix s’est fixé sur deux températures extrêmes par rapport à une température optimale dont on a identifié par la suite leurs effets sur la germination et sur la dégradation et la mobilisation des réserves protéiques et minérales des graines du gombo (variété Marsaouia).
2. Matériel et méthodes
2.1. Matériel végétal
Les graines de gombo (variété Marsaouia) nous ont été fournies par la société "Baddar", il s’agit d’une variété locale. Les expériences de germination et de levée se sont déroulées sous des conditions contrôlées du laboratoire.
2.2. Conditions de germination
Les graines de gombo sont stérilisées par l’alcool éthylique (70°C) pendant une minute, puis trempées dans l’hypochlorite de sodium à 15% (v/v) pendant 20 minutes. La mise en germination des graines est réalisée sous hotte à flux laminaire afin de s’assurer des conditions aseptiques et d’éviter toute contamination. Après rinçage à l’eau distillée stérile, les graines stérilisées sont ensemencées dans des boites de Pétri de 90 mm de diamètre tapissées de deux couches de papier filtre imbibées d’eau distillée stérile à raison de 25 graines par boite. La germination est effectuée à l’obscurité dans des germoirs à température réglable (25 et 40°C) et dans une enceinte réfrigérée (10°C). Les boites sont soigneusement fermées et entourées avec du parafilm afin d’éviter l’évaporation de la solution d’imbibition.
Le critère de germination retenu correspondant à la sortie de la radicule hors des téguments de 2 mm. La germination est suivie pendant 12 jours et elle est relevée tous les deux jours, afin de déterminer l’énergie germinative et le pouvoir germinatif.
2.3. Test de réversibilité de germination
Ce test concerne les graines mises en germination à 10 et 40°C imbibées avec de l’eau distillée. Il s’agit de transférer les graines qui n’ont pas germé au bout de 24 heures, à 25°C pendant une durée de 6 jours.
2.4. Test de viabilité des graines
Ce test concerne les graines qui n’ont pas germé à 10 et 40°C, elles sont décortiquées puis elles sont trempées dans une solution de triphényl-tétrazolium (0.1%) à l’obscurité. La viabilité des graines s’observe par la coloration en rouge des parties vivantes après une heure de trempage (Guy 1993, 2000).
2.5. Détermination de la teneur en eau
Le poids frais des graines mises en germination à 10, 25 et 40°C a été mesuré toutes les deux heures pendant 24 heures, le poids sec est déterminé après séchage des échantillons à 80°C pendant 48 heures. La teneur en eau des graines est déterminée par la différence entre la masse de matière fraîche et la masse de matière sèche rapportée à la matière sèche, elle est exprimée en ml H2O.g-1MS.
2.6. Dosage des protéines solubles
Le dosage des protéines en solution est déterminé par la méthode de Bradford (1976), 100 g de matière fraîche (cotylédons+embryons) est homogénéisée dans une solution tampon phosphate 0.1 M (pH 7). L’homogénéisât est centrifugé à 13000 rpm pendant 45 min, à 1ml du surnageant on ajoute 5ml de réactif de Bradford et le mélange est incubé pendant 15min à l’obscurité. La variation d’absorbance est mesurée au spectrophotomètre à 595 nm et convertie en mg protéines/ g de matière fraîche. Une gamme étalon est établie à l’aide d’une solution de sérum albumine de bœuf (BSA).
2.7. Détermination de l’activité protéasique
La mesure de l’activité de l’enzyme protéase a concerné les cotylédons et l’embryon de la graine, elle est déterminée selon la méthode d’Anson (Yang and Huang 1994). Pour cela, 100 mg de matériel végétal frais ont été broyés à froid (glace) dans une solution tampon de phosphate 0.1 M (pH 7). Le broyat est ensuite centrifugé à 13000 rpm pendant 45 min, le surnageant récupéré constitue l’extrait enzymatique qui est utilisé pour mesurer l’activité de l’enzyme protéase. Cette dernière est déterminée à partir de 1 ml d’extrait en présence de 1 ml d’une solution de caséine à 1%. Après 20 min d’incubation à 37°C, la réaction est arrêtée par addition de 3 ml d’une solution d’acide trichloroacétique à 10%. La tyrosine libérée est dosée à 280 nm au spectrophotomètre (Camspec M330 UV/Vis). L’activité spécifique est exprimée en A280/min/g de matière fraîche.
2.8. Dosages des ions Na+, K+ et Ca++
Les graines sont séchées à l’étuve pendant 48 heures à 80°C, puis elles sont placées dans des piluliers contenant chacun 25 ml d’une solution d’acide nitrique (0.1 N). L’extraction des ions dure 48 heures à la température ambiante du laboratoire. Les cations Na+, K+ et Ca++ sont dosés par spectrophotométrie de flamme en émission (type Eppendorf). Les concentrations sont exprimées en µeq/g MS.
2.9. Analyse statistique
Le dispositif expérimental adopté est randomisé, le nombre de répétitions est de 8 boites par traitement et les expériences ont été répétées trois fois. L’analyse statistique a été réalisée grâce aux procédures des modèles linéaires générales (GLM) du logiciel SPSS (13.0). Le niveau de la signification a été évalué selon le test de Duncan au seuil de 5%.
3. Résultats
3.1. Effet de la température sur la germination
La figure 1 montre que les graines ne germent qu’à 25°C avec un temps de latence d’un jour. Le pouvoir germinatif est de 96% après un temps d’incubation de deux jours. Ce taux augmente jusqu’à 99.5% au bout de six jours. Un taux de germination optimal et maximum de 100% est atteint au huitième jour. Cependant, les graines qui sont incubées pendant 12 jours à 10 et 40°C se montrent inaptes à la germination.
|
Temps (jours) |
|
Figure 1 : Effet de la température (10, 25 et 40°C) sur le pouvoir germinatif des graines de gombo |
3.2. Test de réversibilité de la germination
Les résultats obtenus dans la figure1 montrent qu’aussi bien à une haute qu’à une basse température la germination est inhibée. Un test de réversibilité parait nécessaire pour préciser s’il s’agit d’une perte de viabilité ou d’une entrée en dormance de l’embryon. Le transfert ultérieur des graines de 40 °C à une température optimale de germination (25°C) a donné un taux nul de germination. Par ailleurs, le transfert des graines de 10°C à 25°C a entraîné une reprise de la germination seulement pour quelques graines avec une capacité germinative de 6% (figure 2).
|
|
|
Figure 2 : Effet de test de réversibilité de la germination pour des graines imbibées dans l’eau distillée pendant 24 heures à 10 et 40°C et mises en germination à 25°C (température optimale). Chaque valeur représente la moyenne de trois répétitions. Les barres représentent les erreurs standard (ES). |
3.3. Test de viabilité des graines
Le test de viabilité au tétrazolium appliqué sur les graines qui n’ont pas germé à 10 et 40°C a montré que l’embryon et les cotylédons n’ont pas perdu leur viabilité après une durée d’imbibition de 48 heures.
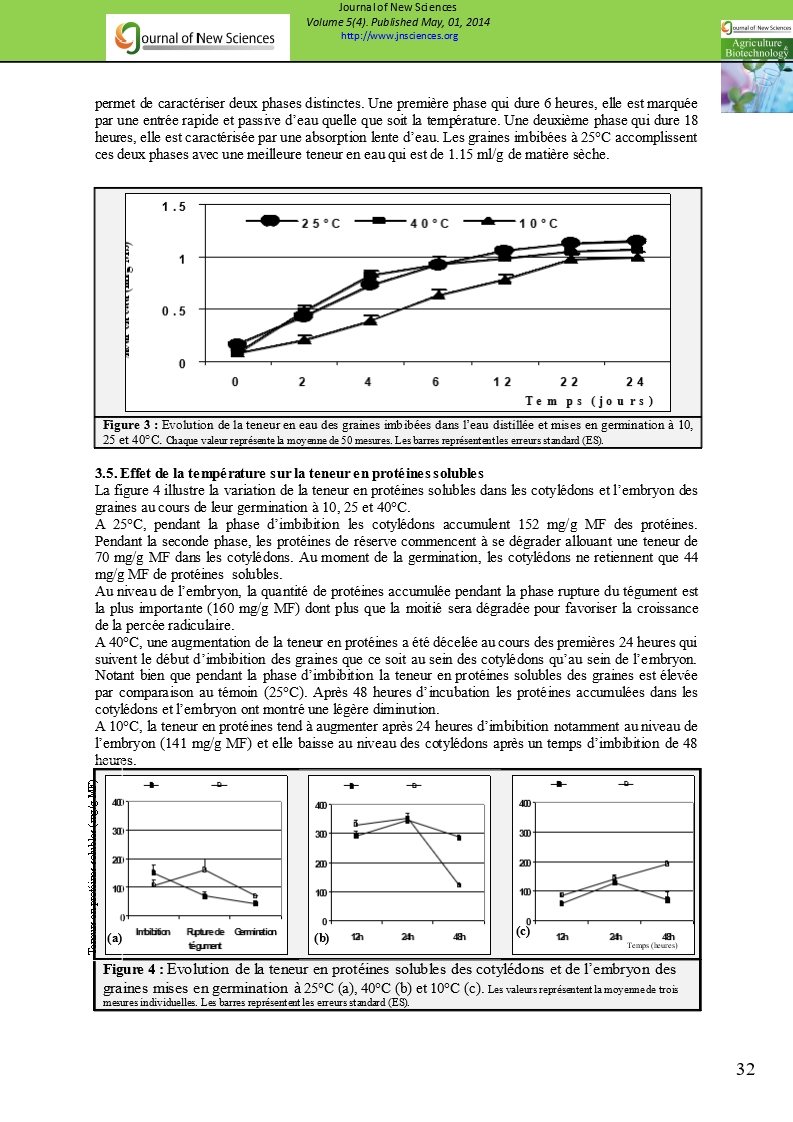
3.4. Effet de la température sur la teneur en eau des graines
Les graines sèches ont une teneur en eau de 0.1 ml/g MS, l’hydratation des graines du gombo est dépendante de la température comme s’est indiquée dans la figure 3. L’absorption d’eau est relativement lente à 10°C et elle est plus importante à 25 et 40°C. La cinétique de la prise d’eau permet de caractériser deux phases distinctes. Une première phase qui dure 6 heures, elle est marquée par une entrée rapide et passive d’eau quelle que soit la température. Une deuxième phase qui dure 18 heures, elle est caractérisée par une absorption lente d’eau. Les graines imbibées à 25°C accomplissent ces deux phases avec une meilleure teneur en eau qui est de 1.15 ml/g de matière sèche.
|
|
|
Figure 3 : Evolution de la teneur en eau des graines imbibées dans l’eau distillée et mises en germination à 10, 25 et 40°C. Chaque valeur représente la moyenne de 50 mesures. Les barres représentent les erreurs standard (ES). |
3.5. Effet de la température sur la teneur en protéines solubles
La figure 4 illustre la variation de la teneur en protéines solubles dans les cotylédons et l’embryon des graines au cours de leur germination à 10, 25 et 40°C.
A 25°C, pendant la phase d’imbibition les cotylédons accumulent 152 mg/g MF des protéines. Pendant la seconde phase, les protéines de réserve commencent à se dégrader allouant une teneur de 70 mg/g MF dans les cotylédons. Au moment de la germination, les cotylédons ne retiennent que 44 mg/g MF de protéines solubles.
Au niveau de l’embryon, la quantité de protéines accumulée pendant la phase rupture du tégument est la plus importante (160 mg/g MF) dont plus que la moitié sera dégradée pour favoriser la croissance de la percée radiculaire.
A 40°C, une augmentation de la teneur en protéines a été décelée au cours des premières 24 heures qui suivent le début d’imbibition des graines que ce soit au sein des cotylédons qu’au sein de l’embryon. Notant bien que pendant la phase d’imbibition la teneur en protéines solubles des graines est élevée par comparaison au témoin (25°C). Après 48 heures d’incubation les protéines accumulées dans les cotylédons et l’embryon ont montré une légère diminution.
A 10°C, la teneur en protéines tend à augmenter après 24 heures d’imbibition notamment au niveau de l’embryon (141 mg/g MF) et elle baisse au niveau des cotylédons après un temps d’imbibition de 48 heures.
|
(a) |
(b) |
Temps (heures) (c) |
|
Figure 4 : Evolution de la teneur en protéines solubles des cotylédons et de l’embryon des graines mises en germination à 25°C (a), 40°C (b) et 10°C (c). Les valeurs représentent la moyenne de trois mesures individuelles. Les barres représentent les erreurs standard (ES). |
||
3.6. Effet de la température sur l’activité protéasique
L’activité de l’enzyme protéase est sensible à l’effet de la température (figure 5), elle est stimulée par les températures défavorables à la germination (10 et 40°C).
A 25°C, pendant la phase d’imbibition, les cotylédons sont le siège d’une activité enzymatique intense c’est pendant cette phase qu’il y aura dégradation des protéines de réserves (figure 5 a). La phase rupture du tégument est marquée par une diminution de l’intensité de l’activité protéasique de 5 fois moins par rapport à celle atteinte pendant la phase d’imbibition. Une fois que la radicule a percé le tégument de la graine, les protéases ont repris leur niveau initial d’activité malgré la faible teneur en protéines solubles dans les tissus de réserve.
Au niveau de l’embryon l’enzyme protéase est plus active pendant la phase rupture du tégument et un peu moins au moment de la germination.
A 10°C, l’imbibition des graines déclenche tôt le processus de dégradation des protéines dans les cotylédons et avec une intensité moins faible au niveau de l’embryon (figure 5 b). Après un temps d’imbibition de 24 heures, la teneur en protéines des cotylédons diminue ainsi que l’activité de l’enzyme hydrolytique commence à s’inhiber. Néanmoins, au niveau de l’embryon l’activité de l’enzyme protéase est plus intense afin de dégrader les protéines accumulées dans l’organe de croissance.
A 40°C, d’après la figure 5 c on note qu’au niveau de l’embryon se déclenche une activité enzymatique plus intense que celle atteinte à 25°C, après 24 heures d’imbibition l’activité protéasique baisse conformément à la quantité des protéines qui diminue aussi. Au niveau des cotylédons, les protéases maintiennent leur niveau d’activité jusqu’à 48 heures d’imbibition.
La variation de l’activité protéasique est significative à 10, 25 et 40 °C au cours du temps et au niveau de l’embryon et des cotylédons.
|
(a) |
(b) |
(c) Temps (heures) |
|
Figure 5: Activité protéasique des cotylédons et de l’embryon des graines du gombo mises en germination à 25°C (a), 40°C (b) et 10°C (c). Les valeurs représentent la moyenne de trois mesures individuelles (±ES). |
||
3.7. Effet de la température sur la mobilisation des réserves minérales
Les teneurs en sodium, calcium et potassium des graines non germées à 10 et 40°C sont énumérées dans le tableau 1, elles sont comparées à celles des graines germées à 25°C.
Il ressort des résultats obtenus que la température a montré un effet significatif sur l’accumulation d’élément sodium. Le test de comparaison des moyennes effectué au seuil de 5% nous a permis de distinguer deux groupes; un premier groupe représenté par la température 25°C et un deuxième groupe formé par les températures 10 et 40°C.
En effet, la teneur en sodium est nettement élevée (1329 et 1478 µeq/g MS) à 10 et 40°C, alors que cette teneur est de loin plus faible à 25°C (378 µeq/g MS). La teneur en calcium dans les graines n’est pas statistiquement modifiée avec la température, elle varie entre 708 µeq/g MS (40°C) et 735 µeq/g MS (25°C).
De même, les différentes températures n’ont pas montré de différences significatives pour la teneur en potassium, cette dernière a pris des valeurs qui s’arrangent entre 413 µeq/g MS (10 et 25°C) et 441 µeq/g MS (40°C).
|
Tableau 1: Teneurs (µeq/g MS) en sodium, calcium et potassium des graines à 10, 25 et 40 °C. |
|||
|
|
10°C |
25°C |
40°C |
|
Sodium |
1329b |
378a |
1478b |
|
Calcium |
719a |
735a |
708a |
|
Potassium |
413a |
413a |
441a |
Les moyennes de la même colonne présentant des lettres différentes en exposant diffèrent significativement au seuil de 5% par le test de Duncan.
4. Discussion et Conclusion
Le passage de la vie latente à la vie active de la graine nécessite comme il est connu son imbibition. Au fur et à mesure que la teneur en eau augmente, l’intensité respiratoire croît et par suite les besoins en oxygène. Mais le phénomène respiratoire, l’hydrolyse des réserves et les activités enzymatiques qui font suite demeurent sous la dépendance de la température.
Le seuil de température pour la germination du gombo est de 16°C, une basse température retarde la germination (Hussain et al. 2006). Chez le tournesol, le seuil de température pour la germination est de 4°C, une température d’au moins 8 à 10°C est nécessaire pour une bonne germination suite à un semis direct au champ (Ebrahimi 2008). Chez le colza, l’optimum thermique se situe entre 15 et 25°C, la germination est inhibée à 5°C (Puppala et al.1999). Les basses températures ont entraîné un retard ainsi qu’une diminution du pouvoir germinatif des graines du colza (Acharya et al.1983, Kondra et al.1983, King et al. 1986, Barber et al. 1991, Wilson et al.1992).
Nos résultats montrent que l’optimum thermique pour la germination des graines du gombo est situé à 25°C. Les graines mises en germination à 40°C subissent une inhibition thermique, ce phénomène a été largement démontré chez des graines de céleri (Biddington 1981), de laitue (Khan 1980,1981) et d’épinard (Leskovar et al.1999). Le test au tétrazolium révèle que les différents tissus de la graine restent viables, ce qui nous permet de distinguer que cette haute température n’a pas endommagé l’embryon et il est possible que la quantité d’oxygène qui arrive à l’embryon sous la forme soluble dans l’eau ne soit pas suffisante pour permettre sa germination. Moore (1985) ont rapporté que l’embryon exige plus d’oxygène quand la température de germination augmente, le manque d’oxygène peut provoquer l’entrée en dormance secondaire de l’embryon (dormance induite). Par exemple chez les graines de tournesol, l’optimum thermique de germination est de 25 à 30°C, un traitement de courte durée (1 à 2 jours) à 40-45°C, inhibe la germination. Egalement, nos résultats révèlent une inhibition de la germination sous une température de 10°C, un transfert de ces graines à 25°C entraîne une reprise de la germination mais avec un faible pouvoir germinatif, les graines n’ont pas perdu leur viabilité et l’embryon a entré en dormance. L’ampleur de l’hydratation des graines a été évaluée par la mesure de la teneur en eau sur la base de la matière sèche. Les résultats obtenus montrent que les graines imbibées à 25°C ont accomplit leur germination, elles ont accédé à la phase de protursion de la radicule avec une meilleure teneur en eau. A 10°C, l’absorption d’eau par les graines est moins rapide, ce résultat confirme celui de Nykiforuk et Flanagan (1999) qui indique que des basses températures de 6 et 10°C entraînent une diminution de la vitesse d’absorption d’eau par les graines du colza pendant la phase d’imbibition.
Par la suite, on constate qu’après 44 heures d’imbibition la quantité d’eau absorbée par les graines à 25°C est avoisinante de celle absorbée à 10 et 40°C. Par conséquent, l’inaptitude à la germination du gombo à 10 et 40°C ne peut pas être attribuée à des difficultés d’absorption d’eau au cours de la phase d’imbibition.
De même, les protéases jouent un rôle primordial durant la germination, elles sont impliquées dans les processus de dégradation des protéines accumulées dans les tissus de réserves et de leur transport sous forme d’acides aminés vers l’embryon. Ces hydrolysats sont absorbés par l’embryon et sont à l’origine de nouveaux acides aminés et de la synthèse de protéines dans les organes en croissance (Ashraf et al.1995).
L’imbibition des graines stimule énormément l’activité protéasique au niveau des cotylédons, c’est au cours de la phase rupture de tégument que l’activité de l’enzyme est accélérée au niveau de l’embryon et ce qui se synchronise en fait avec une teneur élevée en protéines. Il semble que la radicule de l’embryon du gombo comme celle de l’embryon de petit pois (Murray et al. 1979) possède des tissus de réserve contenant des corps protéiques, et que les étapes précoces de la croissance de l’axe embryonnaire (dés la rupture de tégument) dépendraient d’abord de ses propres réserves puis, ensuite essentiellement de la mobilisation des réserves cotylédonaires. L’apparition de la percée radiculaire est suivie par une rénovation de l’activité des protéases au niveau des cotylédons, cette phase de croissance s’accompagne d’une synthèse de nouveau d’endopeptidases et de carboxypeptidases au niveau des corps protéiques (Côme et Corbineau 1998).
Néanmoins, une température défavorable pour la germination n’a pas diminué l’activité protéasique au contraire celle-ci a atteint des valeurs maximales particulièrement pendant les premières 24 heures qui suivent la mise en imbibition des graines. Sous l’effet d’une basse température (10°C) il y avait un retard dans la dégradation des réserves protéiques au niveau des tissus de réserve ce qui résulte une impulsion sur l’activité de ces enzymes.
Sous une haute température (40°C) l’activité des protéases est énorme au niveau de l’embryon où la teneur en protéines est maximale.
Au-delà des premières 24 heures et jusqu’aux 48 heures après la mise en imbibition des graines, l’activité des protéases est inhibée simultanément au niveau des cotylédons à 10°C justifiant une accumulation des hydrolysats et donc leur conservation puisque les graines ont entré en dormance, et au niveau de l’embryon à 40°C cette fois ci les hydrolysats ne sont pas utilisés malgré leur disponibilité pour la croissance des axes.
Il est importe de signaler que pendant la germination, les graines utilisent les réserves minérales pour assurer le développement de l’embryon. Bien que, dans notre étude on ne remarque pas une utilisation de l’élément potassium pendant la phase germinative, il est possible que cet élément serait exploité pendant les phases ultérieures de croissance. L’élément sodium est le plus affecté par la température, une haute température de 40°C et une basse température de 10°C ne permet que l’utilisation des quantités minimes du sodium en comparaison avec une température de 25°C. Les travaux de Salisbury et Ross (1992), ont mis l’accent sur l’effet d’une haute température lors de la germination des graines et qu’elle incite une accumulation des ions autour de la membrane cellulaire, particulièrement les ions Na+ et Cl- qui manifestent une toxicité provoquant de ce fait une inhibition du processus germinatif.
Une graine du gombo germe à 25°C, où les conditions sont favorables pour acquérir une bonne hydratation en eau dés les premières heures d’imbibition, pour déclencher l’activité protéasique dés la phase imbibition ce qui implique une dégradation des réserves protéiques accumulées au niveau des cotylédons et une utilisation de l’élément sodium pour assurer la croissance de la percée radiculaire. Une basse température de 10°C a entraîné une entrée en dormance de la graine.
5. Références
Acharya SN, Dueck J, Downey RK (1983) Selection an heritability studies on canola rapeseed for low temperature germination. Can J Plant Sci. 63: 377–384.
Albregts EE, Howard CM (1973) Infuence of temperature and moisture stress from sodium chloride salinization on okra emergence. Agronomy Journal 65 : 836-837.
Ashraf MY, Azm AR, Khan AH, Naqvi SSM (1995). Alpha-amylase and protease activities of wheat seedling grown under water stress conditions. Pak. J. Sci. Indust. Res 38: 430-434.
Barber SJ, Rakow G, Downey RK (1991). Laboratory and growth room seed vigor testing of certified canola seed. GCIRC Rapeseed Congress, section C-09, pp. 727–733.
Bewley JD, Black M (1994) Seeds-physiology of development and germination, 2nd edn.: plenum press, New York.
Biddington NL (1981). Themiodormancy and the prevention of desiccation injury in celery
seeds. Ann Appl Biol 98:558-562.
Borthwick HA and Robbins WW (1928). Lettuce seed and its germination. Hilgardia 31:275-305.
Bradford M (1976). A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding. Annal Biochem 72:248–254.
Caboche M, Dubreusqu B, Grappin P, Lepinice L and Nesi N (1998). La germination vient en dormant. Biofutur 175 : 32- 35.
Côme D and Corbineau F (1998). Semences et germination. In: Proc. Physiologie végétale II: Croissance et développement, ed. Hermann and P. Mazliak, p. 185-313.
Demir I (2001). The effects of heat treatment on hardseededness of serially harvested okra seeds lots at optimum and low temperatures. Scientia Horticulturae 89 : 1-7.
Ebrahimi A (2008). Contrôle génétique de la qualité des graines chez le tournesol (Helianthus annuus L.) soumis à la sécheresse. Thèse de Doctorat en Agrosystèmes, Ecosystèmes et Environnement, Université de Toulouse, France. 168p.
Hussain S, Sajid M, Amin M, Alam NU, Zafar I (2006). Response of Okra cultivars (Abelmoschus esculentus) to different sowing times. Journal of Agriculture and Biological Science 1: 55-59.
Gul B, Weber DJ (1999). Effects of salinity, light and temperature on germination in Allenrolfea occidentalis. Can. J. Bot.77: 240–246.
Guy R (1993). Faculté germinative et dormance des semences. Revue Suisse Agric 25 : 106-107.
Guy R. (2000). La germination des semences. Revue suisse Agric 32 : 69-72.
Hawker JS, Jenner, C F (1993). High temperature affects the activity of enzymes in the committed pathway of starch synthesis in developing wheat endosperm. Aust J Plant Physiol 20:197-209.
Kesavan,V. (1985). Phenotypic variation in aibika (Abelmoschus manihot L.medikus. 5th SABRA.
Khan AA (1981). Hormonal regulation of primary and secondary seed dormancy. Israel J. Bot. 29:207-224.
Khemiri H, Belguith H, Jridi T, Ben El Arbi M, Ben Hamida J (2004). Caractérisation biochimique d’une amylase active au cours du processus germinatif des graines de colza (Brassica napus L.). Enzymologie et métabolisme, pp.: 146-149. Congrès International de Biochimie. Marrakech.
King JR, Kondra, ZP, Thiagarajah MR (1986). Selection for fast germination in rapeseed (Brassica napus L. and B. campestris L.). Euphytica 35: 835–842.
Kondra ZP, Campbell DC, King JR (1983). Temperature effects on germination of rapeseed (Brassica napus L. and B. campestris L.), Can. J. Plant Sci 63: 1063–1065.
Leskovar DI, Esensee V, and Belefant-Miller H (1999). Pericarp, leachate, and carbohydrate involvement on thermoinhibition of germinating spinach seeds. J. Amer. Soc. Hort. Sci 124:301 -306.
Mihoub A, Chaoui A, El Ferjani E (2005). Changements biochimiques induits par le cadmium et le cuivre au cours de la germination des graines de petit pois (Pisum sativum L.). C. R. Biologies 328 : 33–41.
Moore RP (1985). Tetrazolium testing manual. Zurich, Switzerland, International seed testing association, 99 p.
Murray D R (1979). Proteolysis in the axis of the germinating pea seed. II. Changes in polypeptide composition. Planta 147: 117–121.
Nykiforuk C L and Johnson Flanagan A M (1994). Germination and early seedling development under low temperature in canola. Crop Science 34: 1047-1054.
Nykiforuk CL, Johnson-Flanagan A.M. (1999). Storage reserve mobilization during low temperature germination and early seedling growth in Brassica napus. Plant Physiol. Biochem 37: 939−947.
Othman Y (2005). Evaluation of barley cultivars grown in Jordan for salt tolerance. Thesis, Jordan University of Science and Technology, Jordan.
Puppala N, Fowler L, Poindexter L and Bhardwaj HL (1999). Evaluation of salinity tolerance of canola germination. p. 251–253. In: J. Janick (ed.), Perspectives on new crops and new uses. ASHS Press, Alexandria, VA.
Salisbury FB, Ross CW (1992). Plant physiology. Wads worth publishing Company. Belmont, California Berkeley. California Agric.Exp. Station.
Shereena J and Nabeesa S (2006). Effect of temperature on protein profile of Pisum sativum L. seeds during germination. Journal of Biological Sciences 6: 1153-1155.
Wilson RE, Jensen EH, Fernandez GCJ (1992). Seed germination response to eleven forage cultivars of Brassica to temperature. Agron. J. 84, 200–202.
Yang SS, Huang CI (1994). Protease production by amylolytic fungi in solid state fermentation. J. Chin. Agric. Chem. Soc 32: 589-601.
