
- Category: Volume 12
- Hits: 7255
Analyse de la Diversité du Blé Dur (Triticum turgidum L. subsp. durum) Moyennant les Fractions de Gluten
E. Babay1,2,3,*
M. Hanana1
R. Mzid1
M. Rodriguez-Quijano3
H. Slim-Amara2
1 Laboratoire de Physiologie Moléculaire des Plantes. Centre de Biotechnologie de Borj-Cédria (CBBC). BP. 901. Hammam Lif 2050, Tunisia
2 Laboratoire de Génétique et Amélioration des Plantes. Institut National Agronomique de Tunisie (INAT). 43, Avenue Charles Nicolle. 1082 Tunis, Tunisia
3 Unidad de Genética. Departemento de Biotecnologia. ETSIA Universidad Politecnica. Ciudad Universitaria s/n. 2080, Madrid. Spain
Keywords: Storage proteins, Glutenin, Gliadin, Homogeneity, Genetic diversity
Résumé - La qualité du blé est définie principalement par les protéines de réserve du grain. La séparation et l’identification de ces protéines est largement utilisée par les techniques de séparation unidimensionnelle (SDS-PAGE et A-PAGE) qui ont prouvé leur efficacité chez les études de diversité génétique. De ce fait, nous avons testé l’homogénéité de cinquante-trois lots variétaux (autochtones et améliorées) de blé dur moyennant le SDS-PAGE afin d’éviter les risques de mélange variétal. La diversité allélique de quarante variétés homogènes au niveau des loci Glu-A1, Glu-B1, Glu-A3, Glu-B3, Glu-B2 et Gli-B1 a été ainsi étudiée. Nous avons identifié 27 types d’allèles exprimés par 51 sous-unités et caractérisés par un indice de diversité D= 0.45. Les génotypes autochtones possèdent un indice de diversité plus important que celui des variétés améliorées.
Mots clé: Protéines de réserve, Gluténine, Gliadine, Homogénéité, Diversité génétique.
-
Introduction
Le blé est la 3ème céréale cultivée dans le monde. Le germoplasme autochtone, du fait de ses potentialités d’adaptation aux conditions pédoclimatiques les plus contraignantes, fait du bassin méditerranéen un centre de diversification et par conséquent une zone de grande variabilité génétique. Des pistes prometteuses peuvent s’ouvrir quant à l’exploitation judicieuse de cette diversité pour le développement de variétés mieux adaptées aux contraintes environnementales et répondant au mieux aux exigences liées à la qualité technologique. En effet, un grand nombre d’accessions locales reste très peu étudié quant à leur diversité allélique des protéines de réserve (gluténine et gliadine).
Plusieurs techniques électrophorétiques ont été développées et améliorées pour l'identification et l’analyse génétique des protéines de réserve, telles que les techniques de SDS-PAGE pour caractériser les sous-unités de gluténine de haut et de faible poids moléculaires (LMW-GS + LMW-GS) (Singh et al. 1991) et la technique A-PAGE pour caractériser les différentes sous-unités de gliadine (Lafiandra and Kasarda 1985).
L’identification variétale par l’analyse des prolamines est possibles, car ces protéines sont produites par une transcription et une traduction directe des gènes, donc elles reflètent directement le génotype et peuvent être utilisées pour étudier la phylogénie. Le large polymorphisme inter-variétal qui existe au sein des prolamines est dû à la présence d’un grand nombre d’allèles au niveau de chaque locus. Ces protéines d’endosperme sont exprimées à partir de plusieurs gènes par locus (Ruiz et al. 2005).
L’utilisation des techniques monodimensionnelles pour la séparation des protéines de gluten chez les céréales est recommandée pour l’identification, la caractérisation et l’étude de la pureté variétale. Les perfections récentes dans les protocoles de séparation de SDS–PAGE ont permis de bien séparer les différents allèles de LMW-GS et ont ouvert la possibilité de les utiliser pour étudier la diversité génétique chez les céréales (Peña et al. 2004 ; Nazco et al. 2014).
La vérification de la pureté variétale est importante pour les agriculteurs (stabilité de rendement / homogénéité du cycle physiologique), les organismes gouvernementaux qui contrôlent l’importation et l’exportation, les moulins, les industries des pâtes et les multiplicateurs de semences. Pour la recherche scientifique, tester la pureté d’un génotype est primordial. En plus, les accidents qui aboutissent au mélange variétal sont très fréquents dans les champs expérimentaux au cours du semis, du battage, de l’étiquetage et du stockage, car plusieurs génotypes peuvent être cultivés dans la même parcelle. Le recours aux ouvriers non qualifiés est un des facteurs qui peut aussi augmenter la probabilité de trouver des lots mélangés et contaminés.
Dans ce cadre, nous avons testé en premier lieu l’homogénéité de cinquante-trois variétés autochtones cultivées en Tunisie et en Espagne. Suite à la sélection des variétés homogènes, nous avons étudié leur diversité au niveau de six loci de gliadines et gluténine (Glu-A1, Glu-B1, Glu-A3, Glu-B3, Glu-B2 et Gli-B1).
-
Matériels et méthodes
Une collection de 53 variétés composée de 28 variétés de blé dur en provenance de la Tunisie (locales, améliorées et introduites) et 25 variétés locales espagnoles (Tab. 1) et deux variétés témoins (Mexicali et Jabato).
-
Analyse d’homogénéité et de diversité
-
Extraction et séparation des fractions de gluten
L’extraction des gluténines a été réalisée selon le protocole de Singh et al. (1991). L'électrophorèse des protéines réduites et alkylées (HMW-GS et LMW-GS) a été réalisée sur SDS-PAGE (polyacrylamide 12%) (Payne et al. 1980). L’analyse des gliadines a été réalisée par électrophorèse sur gel d'acrylamide (7%) A-PAGE avec un tampon de lactate d'aluminium (pH acide) selon Lafiandra and Kasarda (1985).
-
Homogénéités des lots de blé analysés
Une analyse des protéines totales a permis d'étudier l'homogénéité des lots. Selon Igrejas et al. (1997), un lot est considéré homogène si un minimum de cinq profils de cinq grains sont identiques, alors que pour notre analyse nous avons considéré qu’une variété est homogène si les profils protéiques de six grains pris au hasard, à partir d’un lot sont identiques.
|
Tableau 1. Provenance, code, nom, origine et homogénéité des lots des variétés et année d’inscription pour les variétés améliorées selon Deghaïs et al (2007). |
|||
|
Provenance / code |
Nom |
Origine/année |
Homogénéité des lots +/- |
|
BGE 12357 |
Raspinegro |
Espagne |
+ |
|
BGE 12359 |
Recio cañimacizo |
“ |
- |
|
BGE 12384 |
Rojo De Llerna |
“ |
+ |
|
BGE 12392 |
Candeal de Salamanca |
“ |
+ |
|
BGE 12557 |
Almendral |
“ |
+ |
|
BGE 13043 |
Amorós Blanco |
“ |
+ |
|
BGE 13044 |
Duro canario |
“ |
- |
|
BGE 13045 |
Clarofino de Balazote |
“ |
+ |
|
BGE 13063 |
Farto |
“ |
+ |
|
BGE 13081 |
Pisana de Vilanova |
“ |
+ |
|
BGE 13092 |
Valencia Blanco |
“ |
+ |
|
BGE 13095 |
Pauleño de Mula |
“ |
+ |
|
BGE 13587 |
Horcajo |
“ |
+ |
|
BGE 13594 |
Villar de Cañas |
“ |
+ |
|
BGE 13606 |
Fanfarrón |
“ |
+ |
|
BGE 13611 |
Recio de Cañete |
“ |
+ |
|
BGE 13663 |
Rubio Naranjnuelo |
“ |
+ |
|
BGE 13668 |
Claro de la Gineta |
“ |
+ |
|
BGE 13669 |
Blat Fort |
“ |
+ |
|
BGE 13697 |
Raspinegro Velloso |
“ |
+ |
|
BGE 13702 |
Blanqueta |
“ |
+ |
|
BGE 14247 |
Rubio Entrelago de Montijo |
“ |
+ |
|
BGE 18287 |
Raspinegro Cañihueco de Calasparra |
“ |
+ |
|
BGE 18314 |
Recio Cañihueco |
“ |
+ |
|
BGE 18323 |
Recio De Bienservida |
“ |
+ |
|
INGC |
Azizi |
Tunisie |
+ |
|
INGC |
Arbi |
“ |
- |
|
INGC |
Agili |
“ |
- |
|
INGC |
Aouadhi |
“ |
- |
|
INGC |
Aouija |
“ |
- |
|
INGC |
Baidha |
“ |
+ |
|
INGC |
Bidi |
“ |
- |
|
INGC |
Biskri |
“ |
+ |
|
INGC |
Chili |
“ |
+ |
|
INGC |
Derbessi |
“ |
+ |
|
INGC |
Hamira |
“ |
- |
|
INGC |
Inrat69 |
“ |
+ |
|
INGC |
Jenah Khottifa |
“ |
- |
|
INGC |
Mahmoudi |
“ |
+ |
|
INGC |
Ouard Bled |
“ |
- |
|
INGC |
Richi |
“ |
+ |
|
INGC |
Souri |
“ |
- |
|
INGC |
Swabaa Algia |
“ |
+ |
|
COSEM |
Karim |
Tunisie, 1982 |
+ |
|
COSEM |
Khiar |
Tunisie, 1992 |
+ |
|
COSEM |
Maâli |
Tunisie, 2007 |
+ |
|
COSEM |
Nasr 99 |
Tunisie, 2003 |
+ |
|
COSEM |
Om Rabiaa |
Tunisie, 1996 |
+ |
|
COSEM |
Razzek |
Tunisie, 1987 |
- |
|
STIMA |
Grécale |
Italie, 2002 |
+ |
|
STIMA |
Iride |
Italie, 1996 |
+ |
|
STIMA |
Saragolla |
Italie, 2004 |
+ |
|
STIMA |
Maéstrale |
Italie, 2002 |
- |
BGE : Banque de Gène d’Espagne, INGC : Institut National de Grandes Cultures, COSEM : Coopérative Centrale de Semences de Mannouba, STIMA : société importatrice de semences, (+) : lot homogène, (-) : lot hétérogène
Pour construire une matrice, un système binaire est considéré à partir des différents niveaux des bandes relatives aux sous unités de protéines de haut et de faible poids moléculaires ((1) présence et (0) absence de bande dans le même niveau de migration).
Une matrice de similarité par paire est générée avec le logiciel NTSYSpc-2.02j (NTSYS-numérique taxonomie et de l'analyse multivariée ; Rohlf, 1998) en utilisant un coefficient d'adaptation simple (Sokal et al. 1958). Les constructions phylogénétiques sont basées sur la méthode des distances génétiques: UPGMA (Unweighted Pair Group Method with Arithmetic Averages) fondée sur l’Indice de Sokal et Michener (Simple Matching).
La diversité génétique est calculée par l’indice D (Nazco et al. 2014), selon la formule suivante:
Dj = 1 – Σp²ij
Où p est la fréquence de l’ième allèle dans le jème locus.
-
Résultats et discussion
-
Homogénéité
-
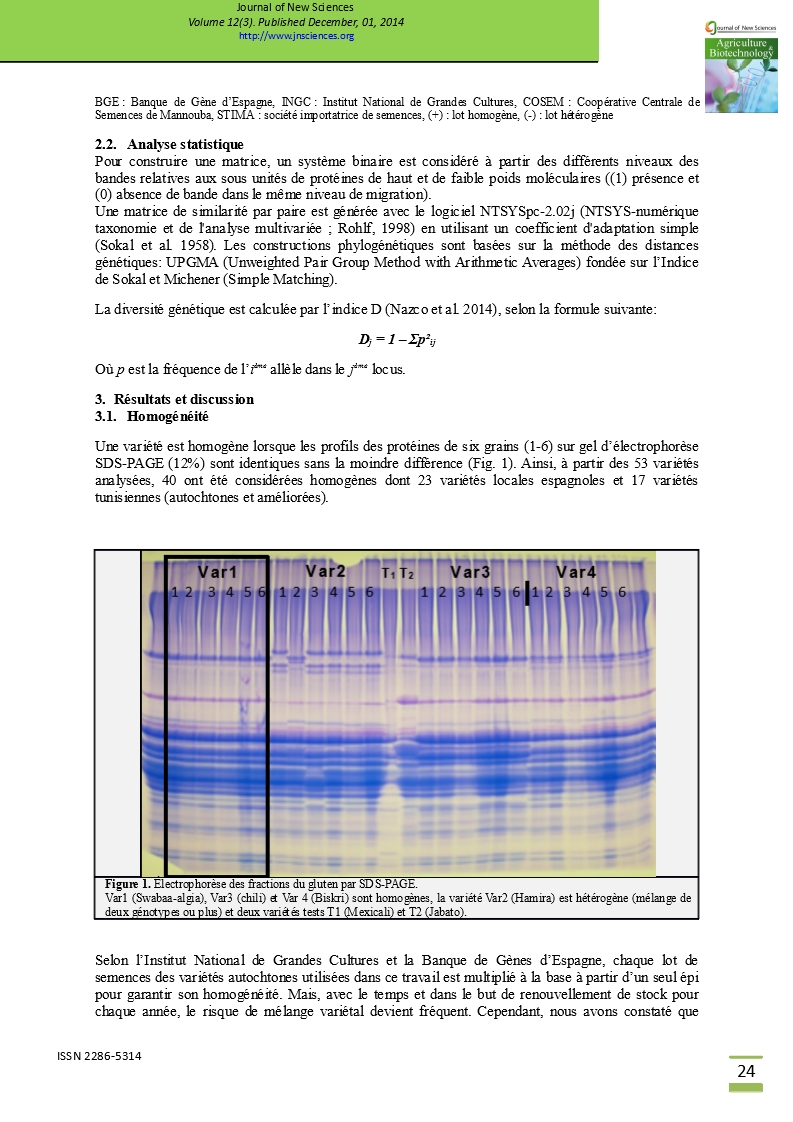
Une variété est homogène lorsque les profils des protéines de six grains (1-6) sur gel d’électrophorèse SDS-PAGE (12%) sont identiques sans la moindre différence (Fig. 1). Ainsi, à partir des 53 variétés analysées, 40 ont été considérées homogènes dont 23 variétés locales espagnoles et 17 variétés tunisiennes (autochtones et améliorées).
|
|
|
Figure 1. Électrophorèse des fractions du gluten par SDS-PAGE. Var1 (Swabaa-algia), Var3 (chili) et Var 4 (Biskri) sont homogènes, la variété Var2 (Hamira) est hétérogène (mélange de deux génotypes ou plus) et deux variétés tests T1 (Mexicali) et T2 (Jabato). |
Selon l’Institut National de Grandes Cultures et la Banque de Gènes d’Espagne, chaque lot de semences des variétés autochtones utilisées dans ce travail est multiplié à la base à partir d’un seul épi pour garantir son homogénéité. Mais, avec le temps et dans le but de renouvellement de stock pour chaque année, le risque de mélange variétal devient fréquent. Cependant, nous avons constaté que 50% des variétés autochtones tunisiennes ne sont pas homogènes. Pour les variétés modernes cultivées et commercialisées par des sociétés agréés qui sont destinées aux agriculteurs, nous avons remarqué que le risque de mélange est aussi important. A partir de 10 variétés améliorées et commercialisées nous avons trouvé 2 variétés qui ne sont pas homogènes (Maéstrale et Razzak).
Au total, à partir de 28 lots de variétés cultivées en Tunisie, nous avons identifié 17 lots homogènes (61%) et à partir de 25 lots de variétés autochtones espagnoles, nous avons trouvé qu’il y a 23 variétés homogènes (92%), soit un total de 40 variétés homogènes (Tab.1).
-
Diversité allélique inter-variétal
Les protéines de réserve sont produites à partir d’une transcription suivie d’une traduction directe de gènes (spécifique pour chaque génotype), donc elles reflètent la diversité génétique entre les espèces et les variétés.
|
|
|
Figure 2. Profil protéique des sous-unités de gluténines de quelques variétés homogènes. Les variétés référence utilisées sont Mexicali (Mex), Alaga (Ala) et Langdom (Lan). |
Le large polymorphisme inter-variétal qui existe au sein des prolamines est le résultat d’un nombre d’allèles élevé au niveau de chaque locus. Dans notre étude la diversité inter-variétale est étudiée au niveau des loci Glu-A1 et Glu-B1 de HMW, Glu-A3, Glu-B3 et Glu-B2 de B-LMW (Fig. 2) et Gli-B1 de γ-gliadine. Ce polymorphisme a été évalué moyennant l’indice D de diversité (Tab. 2).
|
Tableau 2. Indices de diversité totale et spécifique pour chaque locus |
||||
|
|
Toutes les variétés |
Variétés Locales (Espagne) |
Variétés Locales (Tunisie) |
Variétés améliorées
|
|
D (Glu-A1) |
0.48 |
0.66 |
0.22 |
- |
|
D (Glu-B1) |
0.66 |
0.55 |
0.53 |
0.57 |
|
D (Glu-A3) |
0.60 |
0.70 |
- |
0.45 |
|
D (Glu-B3) |
0.45 |
0.45 |
0.47 |
0.25 |
|
D (Glu-B2) |
0.25 |
0.50 |
0.47 |
0.25 |
|
D (Gli-B1) |
0.29 |
0.30 |
0.22 |
0.25 |
|
Indice-D (Totale) |
0.45 |
0.42 |
0.31 |
0.29 |
Au niveau des 40 variétés sélectionnées sur la base de leur homogénéité, nous avons identifié 31 profils différents dont 16 apparaissent seulement chez les variétés autochtones. Nous avons enregistré un indice de diversité total D=0,45. La diversité est plus importante chez les variétés autochtones que chez les variétés améliorées (Tab. 2), ce qui reflète la perte de polymorphisme génétique au niveau des variétés améliorées.
La diversité étudiée au niveau de six loci varie de D= 0.29 à D= 0.70 (Tab. 2). Une diversité importante a été enregistrée au niveau des loci Glu-B1 et Glu-A3, la plus faible diversité est signalée au niveau du locus Gli-B1. Cette diversité donne une idée importante sur la variabilité au niveau de la qualité pour ces variétés. Il a été également démontré que la qualité du gluten du blé dur dépend des sous-unités spécifiques de gluténine et de gliadine exprimés par les loci Glu-A3, Glu-B3, Glu-B2 (Ruiz and Carrillo 1995; Vázquez et al. 1996), Glu-A1 et Glu-B1 (Martinez et al. 2005 ; Edwards et al. 2006) et Gli-B1 (Damidaux et al. 1978 ; Kosmolak et al. 1980 ; DuCros et al., 1982). Chez les variétés autochtones, nous avons enregistré une large diversité au niveau de ces loci, cela traduit une importante variabilité au niveau de la qualité du gluten des variétés autochtones locales par rapport aux variétés modernes.
Le dendrogramme obtenu basé sur la matrice de similarité (Fig. 3), donne un aperçu sur les relations génétiques entre les différents génotypes en fonction de l’expression allélique de chaque locus. En effet, les coefficients de similarité (CS) entre deux variétés varient de 54 à 100 % traduisant une diversité génétique relativement importante. A 60% de similarité, les variétés sont regroupées en deux grands ensembles A et B et a 82% de similarité on obtient 5 groupes: Gr1, Gr2, Gr3, Gr4 et Gr5 (Fig. 3)
|
|
|
Figure 3. Dendrogramme de similarité de 40 variétés de blé dur basé sur les allèles des loci Glu-A1, Glu-B1, Glu-A3, Glu-B3, Glu-B2 et Gli-B1 |
Le premier groupe (Gr 1) contient la majorité des variétés (28), ce groupe est composé de deux sous-groupes. Le premier sous-groupe (S-Gr1) renferme 14 variétés composées de 4 variétés locales tunisiennes (Chili, Mahmoudi, Inrat69 et Richi), une seule variété améliorée (Om Rabiaa) et 9 variétés autochtones espagnoles. Le deuxième sous-groupe (S-Gr2) contient aussi 14 variétés dont 6 améliorées (Iride, Saragolla, Grécale, Khiar, Maâli et Nasr), une variété tunisienne ancienne (Derbessi) et 7 variétés autochtones espagnoles. Le deuxième groupe (Gr 2) contient seulement 2 variétés anciennes espagnoles (Rubio Naranjnuelo et Rojo De Llerna). Le troisième groupe (Gr 3) contient 4 variétés locales tunisiennes (Azizi, Swabaa Algia, Biskri et Baidha). Le Quatrième groupe (Gr 4) contient 3 variétés espagnoles et une variété améliorée (Karim). Le cinquième groupe (Gr 5) contient 2 variétés locales espagnoles.
La similarité la plus faible (54%) est enregistrée entre les deux grands ensembles (A) et (B) (Fig. 3). Cette similarité qui est basée sur des loci (Glu-A1, Glu-B1, Glu-A3, Glu-B3, Glu-B2 et Gli-B1) responsables de la variabilité de la qualité et de la force de gluten (Vázquez et al. 1996 ; Carrillo et al. 1999 ; Martinez et al. 2004 ; Sissons 2008). Il est donc probable que les variétés qui constituent ces deux ensembles aient des forces de gluten et des qualités de pâtes différentes.
Les variétés locales tunisiennes sont localisées dans les 2 groupes, Gr1 (S-Gr1) et Gr3 appartenant à l’ensemble variétal A (Fig.3). Les variétés améliorées, semi-naines, productives et relativement similaires sont rassemblées dans le premier groupe et précisément dans le deuxième sous-groupe (S-Gr2) à l’exception de la variété « Karim » qui se situe au niveau du groupe 4 de l’ensemble B, cette variété serait différente des autres variétés améliorées sur le plan qualitatif. D’ailleurs, d’après Ammar et al. (2010), cette variété possède une faible force de gluten et un faible indice de jaune.
Les variétés locales utilisées dans ce travail ont montré une large variabilité génétique au niveau des chromosomes 1A et 1B, par rapport aux variétés améliorées. Ceci pourrait être traduit par une variation sur le plan qualitatif. De même, des études récentes ont montré l’existence d’une importante variabilité des caractères qualitatifs chez les variétés anciennes de blé dur (Moragues et al. 2006 ; Aguiriano et al. 2008). L’exploitation de cette diversité génétique pourrait aboutir à l’identification de gènes et d’allèles utiles qui seront utilisés dans les programmes d’amélioration de la qualité.
Dans notre étude, les variétés autochtones espagnoles présentent une diversité génétique plus large que les variétés autochtones tunisiennes. Ceci pourrait être dû au nombre élevé des variétés espagnoles locales (23) qui dépassent le double de celui des variétés tunisiennes anciennes (9). Cette diversité observée pourrait être également liée aux conditions climatiques tunisiennes sévères (Climat semi-aride et stress abiotique) responsables d’une sélection naturelle de variétés plus adaptées et vers lesquelles les agriculteurs se sont orientés.
-
Conclusion
Les optimisations des protocoles de séparation monodimensionnelle de SDS–PAGE ont permis de mieux séparer les différents allèles de LMW et HMW afin de les utiliser convenablement dans l’étude de la diversité génétique.
L'identification allélique des protéines de réserve des variétés de blé a révélé une diversité importante. Même si d'autres méthodes telles que les réactions de polymérisation en chaînes (PCR) peuvent fournir d’intéressants outils pour ce type d'étude, l’utilisation de SDS-PAGE monodimensionnelle s’est avérée tout aussi utile, efficace et économique particulièrement avec des gels de haute résolution. L’analyse des allèles des protéines de réserve est bien connue pour être un outil puissant pour le génotypage des ressources génétiques tandis que l’analyse des gluténines et des gliadines avec le SDS- PAGE et A-PAGE fournit un outil facile pour l’identification des allèles.
D’après nos résultats, l’utilisation des techniques de SDS-PAGE peut être recommandée dans l’analyse de l’homogénéité variétale par les producteurs de semences et les organismes de contrôle afin de garantir aux agriculteurs une variété homogène et offrir aux industriels et consommateurs une qualité uniforme et stable.
-
Références
Ammar k, gharbi ms, deghaies m (2011) wheat in tunisia. In: bonjean ap, angus m., van ginkel m (ed) the world wheat book, a history of wheat breeding, volume 2, edit tec and doc, pp 443-466.
Aguiriano A, Ruiz M, Fité R, Carrillo JM (2008) Genetic variation for glutenin and gliadins associated with quality in durum wheat (Triticum turgidum L. ssp. turgidum) landraces from spain. Spanish Journal of Agricultural Research, 6: 599-609.
Damidaux R, Autran JC, Grignac L, Feillet P (1978) Mise en évidence de relations applicable en sélection entre l’électrophoregrame des gliadines et les propriétés viscoélastiques du gluten de Triticum durum Desf. wheat. C.R. Acad. Sci. Ser. D, 287: 701-704.
Deghaïs M, Kouki M, Gharbi M, El Felah M (2007) Les variétés de céréales cultivées en Tunisie (blé dur, blé tendre, orge et triticale) 445pp.
DuCros DL, Wrigley CW, Hare RA (1982) Prediction of durum wheat quality from gliadin-protein composition. Aust J Agr Res, 33: 297-302.
Edwards NM, Gianibelli MC, McCaig TN, Clarke JM, Ames NP, Larroque OR, Dexter JE (2007) Relationships between dough strength, polymeric protein quantity and composition for diverse durum wheat genotypes. J Cereal. Sci, 45: 140-149.
Igrejas G. Branlard G, Carnide V, Gateau I, Guedes-Pinto H (1997) Storage protein diversity within the old Portuguese bread wheat Barbela population. Journal of Genetics and Breeding. 51, 167-173.
Igrejas G, Guedes-Pinto H, Carnide V, Branlard G (1999) The high and low molecular weight glutenin subunits and ω-gliadin composition of bread and durum wheats commonly grown in Portugal. Plant breeding. 118, 297-302.
Lafiandra D, Kasarda DD (1985) One and two-dimensional (two pH) polyacrylamide gel electrophoresis in a single gel: separation of wheat proteins. Cereal Chem, 62: 314–319.
Martinez MC, Ruiz M, Carrillo JM (2005) Effects of different prolamin alleles on durum wheat quality properties. J Cereal Sci, 41: 123–131.
Martinez MC, Ruiz M, Carrillo JM (2004) New B low Mr glutenin subunit alleles at the Glu-A3, Glu-B2 and Glu-B3 loci and their relationship with gluten strength in durum wheat. J Cereal Sci, 40: 101–107.
Moragues M, Zarco-Hernandez J, Moralejo MA, Royo C (2006) Genetic diversity of glutenin protein subunits composition in durum wheat landraces (Triticum turgidum ssp. turgidum convar. durum (Desf.) Mackey from the Mediterranean basin. Genet Resour Crop Ev, 53: 993-1002.
Nazco R, Peña, RJ, Ammar K, Villegas D, Crossa J, Moragues M, Royo C (2014) Variability in glutenin susbunit composition of Mediterranean durum wheat germoplasm and its relationhip with gluten strength. Agr Sci J, 10: 1-5.
Payne PI, Law CN, Mudd EE (1980) Control of homologous group 1 chromosomes of the high molecular weight subunits, a major protein of wheat endosperm. Theor Appl Genet, 58: 113-120.
Peña RJ, Gonzalez-Santoyo H, Cervantes F (2004) Relationship between Glu-D1/Glu-B3 allelic combinations and bread-making quality-related parameters commonly used in wheat breeding. In The Gluten Proteins. Proceedings of the 8th Gluten Workshop, 8010 September 2003, Viterbo, Italy (Eds S, Masci D, Lafiandra D, D’Ovidio R). Cambridge, UK: Royal Society of Chemistry, pp 156–157.
Ruiz M, Carrillo JM (1995) Separate effects on gluten strength of Gli-1 and Glu-3 prolamin genes on chromosomes 1A and 1B in durum wheat. J Cereal Sci, 21: 137-144.
Ruiz M, Vázquez JF, Carrillo JM (2005) Genetic bases of grain quality. In: Durum wheat Breeding, current approaches and future strategies (Royo C, Nachit MM, Di Fonzo N, Araus JL, Pfeiffer WH, Slafer GA) (ed) Food Product Press Volume 1: 349-375.
Singh NK, Shepherd KW, Cornish GB (1991) A simplified SDS-PAGE procedure for separating LMW subunits of glutenin. J Cereal Sci, 14: 203–208.
Sisson M (2008) Role of durum wheat composition on the quality of pasta and bread. Food, Global Science Books, 2: 75-90.
Sokal RR, Michener CD (1958) A statistical method for evaluating systematic relationships. The University of Kansas science bulletin, 38: 1409-1438.
Vázquez JF, Ruiz M, Nieto-Taladriz MT, Albuquerque MM (1996) Effects on gluten strength of low Mr glutenin subunits coded by alleles at the Glu-A3 and Glu-B3 loci in durum wheat. J Cereal Sci, 24: 125–130.

