
- Category: Volume 3
- Hits: 9463
Comportement et stratégies d’adaptation de vignes franches de pied sous stress salin
M. Hanana 1*
L. Hamrouni 2
K. Ben Hamed 3
A. Ghorbel 1
C. Abdelly 3
1 Laboratoire de Physiologie Moléculaire des Plantes, Centre de Biotechnologie de Borj-Cédria, BP 901, Hammam-lif 2050, Tunisie.
2 Laboratoire d’Ecologie Forestière, Institut National de Recherches en Génie Rural, Eaux et Forêts, P.B. 10, 2080 Ariana, Tunisie.
3 Laboratoire des Plantes Extrêmophiles, Centre de Biotechnologie de Borj-Cédria, BP 901, Hammam-lif 2050, Tunisie.
Summary - In order to select and identify grapevine genotypes adapted to environmental conditions and tolerant to salinity, we analyzed and evaluated, in a preliminary attempt, the behavior of grapes varieties cultivated on their own roots against salt constraint. In this respect, six varieties have been considered (Superior Seedless, Syrah, Muscat d’Italie, Cardinal, Razegui and Asli) within own root culture assay that was conducted under greenhouse and controlled conditions. Thus, homogenous plants obtained from cutting were cultivated in pots filled with sandy soil and irrigated with nutritive solution added with 100 mM NaCl. After 75 days of treatment, measures were realized on the agronomical characters related to plant growth, photosynthetic capacity and physiological parameters related to plant mineral content. Our results showed that salinity tolerance of own rooted grapes is tightly related to the preservation of their original growth vigor, and the physiological mechanisms of salt tolerance are based on their ability to maintain the photosynthetic activity despite of the stress and the capacity to follow a strategy of chloride/sodium exclusion (especially in the old basal leaves) with restriction of their entry and uptake. Osmotic adjustment via leaf potassium accumulation (up to 1400 μmol.g-1 MS within Cardinal tolerant variety), salt stress signalization and cellular protection of components through leaf calcium accumulation represent additional mechanisms of salt tolerance.
Keywords: Osmotic adjustment, exclusion, salinity tolerance mechanisms.
Résumé - Afin d’identifier et de sélectionner des génotypes de vigne adaptées aux conditions de l’environnement et tolérant la salinité, nous avons dans un premier temps cherché à définir et évaluer le comportement inhérent de variétés franches de pied vis-à-vis de la contrainte saline. Pour ce faire, six variétés (Superior Seedless, Syrah, Muscat d’Italie, Cardinal, Razegui et Asli) ont été considérées dans un essai de culture sur franc de pied conduit sous serre vitrée en conditions contrôlées. A cet effet, des plants homogènes, obtenus par bouturage, ont été cultivés en pots remplis de sable inerte et irrigués avec une solution nutritive additionnée de 100 mM NaCl. Au terme de 75 jours de traitement, les mesures ont porté sur les caractères agronomiques liés à la croissance, la capacité photosynthétique de la plante et les paramètres physiologiques relatifs à la nutrition minérale. Les résultats obtenus montrent que la tolérance à la salinité des variétés franches de pied est étroitement liée au maintien d’une vigueur de croissance originale et que les mécanismes physiologiques de tolérance reposent sur leur aptitude à maintenir l’activité photosynthétique malgré le stress et leur capacité d’adoption de la stratégie d’exclusion (particulièrement au niveau des feuilles basales âgées) du sodium et celle des chlorures tout en restreignant leur absorption et accumulation. L’ajustement osmotique, via l’accumulation foliaire de potassium (jusqu’à 1400 μmol.g-1 MS chez la variété tolérante Cardinal), ainsi que la signalisation du stress et la protection des composés cellulaires à travers le calcium foliaire, sont des mécanismes de tolérance additionnels.
Mots clés: Ajustement osmotique, exclusion, mécanismes de tolérance à la salinité.
1. Introduction
La plupart des vignes dans le monde sont cultivées sur des porte-greffes, surtout depuis l’épidémie du phylloxéra à la fin du 19ème siècle, qui a ravagé et décimé pratiquement tous les vignobles dont les cépages étaient cultivés sur franc de pied (Ollat et al. 2009). Les cépages européens ont été alors greffés sur des pieds de vignes américaines, les porte-greffes, qui sont naturellement résistants au phylloxéra (Legros 2005). Seuls quelques minuscules vignobles ont été épargnés par ce fléau, grâce à un sol sablonneux ou une haute altitude (où le phylloxéra ne survit pas). Pourtant, plusieurs vignerons soutiennent que les vignes franches de pied ont la faculté de s’autoréguler et de capter bien mieux l’essence du terroir. Des recherches pour un retour à une vigne franche de pied, c’est-à-dire sans porte-greffes, sont en cours. La connaissance du comportement phénotypique d’une variété de vigne franche de pied est généralement délaissée au profit d’une considération globale de la combinaison et interaction scion/porte-greffe. En effet, peu d’informations sont disponibles quant au comportement intrinsèque des variétés de vigne vis-à-vis du stress salin. L’objectif de notre travail consiste à déterminer et évaluer le comportement physiologique de vignes franches de pied vis-à-vis de la salinité. Il ne s’agit pas de vouloir remplacer les vignes actuelles greffées, mais de définir les mécanismes de tolérance à la salinité chez la vigne et de mieux comprendre le comportement intrinsèque d’une variété sur ses propres racines afin de considérer de façon intégrale les interactions au sein des combinaisons variété/porte-greffe et de proposer de meilleures associations en fonction des conditions de culture. En effet, la compréhension des mécanismes physiologiques régissant l’adaptation des plantes aux stress de leur environnement apparaît comme une nécessité fondamentale étant donné qu’elle représente la clé pour accéder à l’amélioration et la sélection de génotypes tolérants. Généralement c’est l’effet du porte-greffe sur la nutrition minérale des plantes en conditions de stress salin qui est étudié, mais sur franc de pied, aucune étude n’a porté sur la vigne. L’objectif de ce travail est d’étudier le comportement physiologique des variétés de vigne, sur leurs propres racines, soumises au stress salin par l’addition de NaCl (100 mM) dans la solution nutritive en vue de déterminer leurs limites de tolérance au sel et d’identifier les mécanismes physiologiques impliqués dans les stratégies de résistance à cette contrainte abiotique.
2. Matériel et méthodes
2.1. Matériel végétal et conduite des cultures
L’étude à porté sur 6 variétés non greffées : Superior Seedless, Syrah, Muscat d’Italie, Razegui, Asli, et Cardinal. Des rameaux lignifiés, aux bourgeons dormants, ont été prélevés sur des ceps de vigne (Vitis vinifera subsp. vinifera) en dormance (novembre-décembre), issus de la collection du parc à bois du Centre de Biotechnologie de Borj-Cédria. Ensuite, ceux-ci sont débités en fragments ligneux portant deux bourgeons. Après éborgnage, les boutures sont trempées à leur base dans de l’exubérone (AIB commercial) afin de favoriser la rhizogenèse, paraffinées et repiquées dans des cagettes remplies de sable qui sont ensuite mises dans une chambre climatique (température 28°C ; photopériode 16 heures et humidité relative 80 %). Au bout de deux semaines, les boutures commencent à débourrer et à développer leur système racinaire. Après enracinement des boutures, les jeunes plants ont été repiqués individuellement dans des pots en plastique de 2 litres contenant du sable inerte, lavé avec de l’acide sulfurique concentré et rincé plusieurs fois avec de l’eau distillée. Après une période d’acclimatation de deux semaines, les boutures enracinées sont irriguées avec une solution nutritive enrichie progressivement en NaCl à raison de 25 mM tous les 15 jours jusqu’à atteindre 100mM. L’essai sous serre a duré 75 jours. Les cultures sont conduites dans une serre vitrée sous éclairage naturel mais avec un éclairement d’appoint. La température moyenne et l’humidité relative sont respectivement de 25 ± 2°C et 70 ±5 % et sous une photopériode de 16 heures.
2.2. Traitement salin
Les irrigations sont réalisées tous les deux jours avec une solution nutritive dont la composition en macroéléments est faite selon la formule de Long Ashton (Hewitt 1952) additionnée de NaCl (100mM). La solution nutritive contient également du fer apporté sous forme de complexe EDTA-K-Fe préparé d’après la formule de Jacobson (1951). Les oligoéléments ajoutés à la solution nutritive sont ceux proposés par Arnon and Hoagland (1940). Les volumes de solution nutritive apportés sont calculés pour représenter 70 % de la capacité au champ et sont suffisants pour provoquer un léger drainage et lessivage. Les plants témoins sont exclusivement irrigués à l’aide la solution nutritive sans addition de NaCl.
2.3. Paramètres analysés
2.3.1. Suivi des cultures
L’aspect morphologique des plantes a fait l’objet d’observations régulières depuis le début de culture jusqu’à la récolte finale. Il a été en particulier tenu compte de la formation de nouveaux organes et de l’apparition des symptômes de toxicité. L’objectif étant de repérer l’impact du sel sur les organes photosynthétiques et de noter les modifications qui seraient impliquées dans la tolérance au sel.
2.3.2. Mesure de la production de biomasse
Deux récoltes sont réalisées : la première a pour objectif de caractériser l’état des plantes au début des traitements : c’est la récolte de départ. La seconde a lieu à la fin des traitements, après deux mois de culture. A la récolte, les plantes sont séparées en parties aériennes (feuilles et tiges) et en racines. Les racines sont rincées dans trois bains successifs d’eau glacée puis épongées et séchées avec du papier filtre. Les différents organes sont rapidement mis dans des sachets en papier aluminium préalablement tarés puis pesés avant et après dessiccation à 60°C pendant 48 heures pour en déterminer les masses en matières fraîche et sèche.
2.3.3. Evaluation de la surface foliaire et nombre de feuilles
La surface foliaire est déterminée pour quatre feuilles prélevées de façon aléatoire à chaque niveau de la plante (basal, médian et apical), à l’aide d’un planimètre (Area Meter, type LI-3000A, LI-COR).
2.3.4. Détermination des teneurs en chlorophylle
La détermination des teneurs en chlorophylle est réalisée sur des feuilles fraîches prélevées sur les plants à la récolte finale.
2.3.5. Détermination de la teneur en eau
La teneur en eau (%) est déterminée par la différence entre la matière fraîche (MF) et la matière sèche (MS), par rapport à la MF.
2.3.6. Détermination de la nutrition minérale
Afin d’analyser le comportement de transport et de stockage des ions au niveau de la plante, nous avons déterminé les concentrations des ions minéraux (sodium, chlore, potassium, calcium et magnésium) au niveau des différents organes (racines, tige et feuilles).
2.4. Méthodes d’analyse
2.4.1. Indice de sensibilité
Il est obtenu en ramenant l’écart entre la production de matière sèche des plantes cultivées en présence de NaCl et celle des plantes témoins par rapport à ces dernières, selon la formule suivante de Slama (1982) :
IS=100(∆MSNaCl - ∆MStémoin)/ ∆MStémoin
∆MSNaCl : variation de la production de la matière sèche sur milieu salé.
∆MStémoin : variation de la production de la matière sèche sur milieu témoin.
2.4.2. Détermination des teneurs en chlorophylle
Les feuilles sont prélevées en fin de culture puis broyées dans une solution d’acétone (100%) et centrifugées à 3000 tr/min durant 10 min. Le culot obtenu sera additionné d’acétone (80 %) refroidi pour être mixé de nouveau puis centrifugé une deuxième fois dans les mêmes conditions. Le surnageant ainsi obtenu est mélangé avec le premier afin de déterminer le volume d’acétone ayant servi pour l’extraction. Pour la détermination de la teneur en chlorophylle, 1ml du surnageant est ajouté à 9 ml d’acétone à 80 %. Le mélange est introduit dans le spectrophotomètre pour être observé à une longueur d’onde égale à 652nm (Arnon 1941; Bruinsma 1961). L’évaluation de la teneur en chlorophylle se fait selon la formule suivante :
Teneur en chlorophylle totale (mg.g-1) = vol d’acétone (ml) x valeur de la lecture x 10 / poids de l’extrait sec (g)
2.4.3. Analyse minérale
Extraction des ions
Après dessiccation, les échantillons (feuilles tiges et racines) sont réduits en poudre fine au moyen d’un broyeur à billes (type Dangoumeau). Le broyage assure une homogénéité des échantillons qui feront l’objet des différentes analyses. Des quantités connues de poudre végétale préalablement desséchée à l’étuve sont mises dans les piluliers en présence d’un volume connu d’acide nitrique 0.5 %. Le rapport matière sèche / volume est de 20 mg de MS pour 50 ml d’acide. Les piluliers hermétiquement fermés pour éviter la concentration des extraits par évaporation sont agités périodiquement 4 à 5 fois par jour. Les extraits sont ensuite filtrés sur papier filtre sans cendre et donc prêts pour le dosage des éléments minéraux (Abdelly 1997).
Dosage des cations
Les cations K+, Ca2+, Na+ et Mg2+ sont dosés par absorption a
tomique (Perkin Elmer Atomic absorption spectrometer 3110).
Dosage du chlorure
Le Cl- est dosé sur les mêmes extraits nitriques, en présence d’un tampon acétique (acide acétique 10 %, acide nitrique 0.1N) et de gélatine, à l’aide d’un chloridomètre digital (type Haake Büchler) selon le principe de titration colorimétrique avec détection de fin de réaction potentiométrique. Des aliquots de 10µl d’une solution étalon à 100 meq.l-1 sont utilisés pour l’étalonnage de l’appareil. A 0.5ml de chaque extrait de l’échantillon, on ajoute 2.5ml d’acide nitrique 0.1N, 1ml de tampon acétique et 4 gouttes de la solution de gélatine. La lecture est faite par rapport à une dizaine de témoins où le filtrat est remplacé par de l’eau distillée (Abdelly 1997).
2.4.4. Sélectivité K+/Na+
Les plantes absorbent puis transportent dans leurs parties aériennes une certaine quantité de potassium indispensable à la croissance. Etant donné l’excès de sodium par rapport au potassium dans le milieu, les plantes doivent maintenir une sélectivité K+/Na+ au niveau de leur système d’absorption, de transport et d’accumulation. La sélectivité est alors définie par la formule suivante :
SK+/Na+ = S1 / S2
S1 = ∆QK / (∆QK + ∆QNa)
S2 = [K+] / ([K+] + [Na+])
∆Q : quantité de l’élément accumulée dans la partie de la plante au cours de la période du traitement exprimée en meq.
[---] : concentration de l’élément dans le milieu de culture exprimée en meq/ml.
De façon plus simplifiée, elle peut être aussi appréciée par le rapport (des quantités) K/Na (Abdelly 1997).
2.5. Analyses statistiques
Le programme ‘Statistical Analysis System’ (SAS, 1988) a été utilisé pour réaliser toutes les analyses de la variance ainsi que le test de Duncan (α = 0.05) afin de comparer les moyennes entre les échantillons témoins et ceux traités pour chaque paramètre analysé.
3. Résultats
3.1. Aspect des plantes
La présence de sel affecte le développement végétatif des plants de vigne, elle inhibe l’allongement des rameaux, l’expansion des feuilles ainsi que leur nombre. Cet effet dépressif est, cependant, plus ou moins accentué selon les génotypes. La figure 1 illustre la variabilité morphologique au sein de deux variétés cultivées sur franc de pied : Razegui et Asli. La première, exprimant des potentialités de croissance élevées en absence de sel, y apparait moins affectée par cette contrainte que la seconde. D’autre part, plusieurs types de nécrose peuvent se développer sur les feuilles : en forme de petites tâches entre les nervures ou encore sous forme de plages périphériques (figure 1b). Le suivi des symptômes a montré que la sévérité de la toxicité foliaire diffère selon la variété et s’accentue au cours du traitement salin. Ainsi, un début de chlorose, avec jaunissement des bordures et de la partie terminale des feuilles, a été observé suite à 15 jours d’irrigation avec 100 mM NaCl et en premier lieu chez la variété Syrah qui affiche déjà une certaine sensibilité. Il en est de même pour la variété Asli mais à un degré moindre. Par contre, à ce stade précoce de traitement salin, les feuilles des variétés Cardinal et Razegui ont conservé leur aspect normal et leur couleur vert-clair. La chlorose ne s’est prononcée qu’à partir de 60 jours de traitement chez Asli et Syrah, et après 75 jours chez le reste des variétés étudiées. Ainsi, chez la vigne cultivée sur franc de pied, les symptômes de toxicité ne tardent pas à se faire apparaitre, particulièrement chez les variétés sensibles.
|
1b 2b
Figure 1 : a : Variabilité morphologique de la réponse au sel chez deux variétés non greffées de vigne, (1) Razegui et (2) Asli. A gauche, plante témoin, et à droite, plante cultivée pendant un mois en présence de sel (100 mM NaCl). b : Développement de halos nécrotiques entre les nervures (1) ou au niveau des extrémités des feuilles adultes sous forme de vastes plages (2) chez la variété Syrah. |
3.2. Croissance des plantes
3.2.1. Production de biomasse
Les variétés retenues dans cette étude n’expriment pas les mêmes potentialités de croissance aussi bien en présence qu’en absence de sel. Selon Champagnol (1984), l’expression de la vigueur végétative peut être évaluée par la quantité totale de matière sèche accumulée dans les parties végétatives de la plante. Nous considérons dans nos travaux que la vigueur d’un plant de vigne est définie, de manière simplifiée, par sa production de matière sèche. En condition idéale (témoin), elles peuvent être classées en 3 groupes selon leur production de MS totale (figure 2) :
-
Variétés vigoureuses : Razegui, Asli et Superior Seedless, produisant plus de 50g MS/plant,
-
Variétés moyennement vigoureuses : Syrah et Cardinal produisant entre 30 et 35g MS/plant, et
-
Variété peu vigoureuse : Muscat d’Italie produisant moins de 15g MS/plant.
En considérant la production de MS racinaire, ce classement ne subit pas de modification. L’application du stress salin entraîne une diminution significative de la production de matière sèche pour toutes les variétés sauf pour Cardinal et Muscat d’Italie qui ne présentent pas une diminution significative de leur matière sèche totale sous stress salin (figure 2). Au niveau racinaire, on observe le même comportement des variétés, sauf que la MS de Syrah (y compris celles de Cardinal et Muscat d’Italie) n’est pas affectée par le traitement salin. Il est important de remarquer que la variété Razegui stressée produit le plus de matière sèche que toutes les autres variétés stressées et autant que les variétés témoins Syrah et Cardinal, en raison de sa bonne vigueur. Néanmoins, malgré sa vigueur, la variété Razegui réduit de moitié sa production de MS (totale et racinaire) suite au stress salin. Pour mieux estimer l’effet du stress salin sur la croissance, nous avons calculé pour chacune des variétés la masse de matière sèche produite en présence de sel en pourcentage de celle mesurée chez les plantes témoins. On constate que le sel réduit fortement la croissance chez les différentes variétés de 30 à 70 %. Les variétés Asli et Syrah sont les plus affectées, leur croissance pondérale est respectivement réduite de 65 et 70 %. La variété Cardinal est la plus tolérante, avec seulement 30 % de réduction de croissance par rapport à son témoin. Entre ces groupes, se situent les variétés Superior Seedless, Muscat d’Italie et Razegui qui affichent approximativement une réduction de moitié de leur croissance par rapport à leurs témoins respectifs. La réduction de MS concerne également la partie racinaire. Celle-ci est la plus marquée chez la variété Syrah, elle atteint 70 % du témoin, mais cette réduction de MS racinaire n’est que de 40 % chez Superior Seedless et Cardinal. La baisse de production de biomasse sèche est une réponse classique à la contrainte saline. L’analyse de la variance pour les variables MS totale montre un effet hautement significatif entre les variétés étudiées. Le classement des moyennes relatives aux valeurs de réduction de la matière sèche suite au traitement salin, montre que la variété Cardinal peut être considérée, à priori, la plus tolérante. Par ordre décroissant de tolérance au sel, les variétés testées se classent alors comme suit :
Cardinal > Superior Seedless > Muscat d’Italie > Razegui > Asli > Syrah
|
Figure 2 : Effet du stress salin (NaCl 100 mM) sur la production de MS totale chez les variétés. Moyenne de 13 répétitions. Les valeurs suivies de la même lettre ne sont pas significativement différentes (Classement des moyennes selon le test de Duncan, α = 0.05). |
Par ailleurs, l’analyse de l’indice de sensibilité confirme cette classification des variétés. D’après cette analyse préliminaire, il s’est avéré que les deux variétés Asli et Syrah sont les plus sensibles, alors que cardinal s’est montrée la plus tolérante à la salinité. Ainsi, contrairement aux porte-greffes (Hamrouni 2009), les variétés les plus vigoureuses, en l’occurrence Razegui et Asli, ne sont pas les plus tolérantes, et de même, les variétés moyennement ou peu vigoureuses telle que Cardinal, ne sont pas forcément sensibles. En effet, la variété Razegui qui est la plus vigoureuse est sensible (moyennement) puisqu’elle voit sa croissance végétative réduite de moitié suite au stress salin. Mais aussi, la variété Cardinal qui est moyennement vigoureuse est la plus tolérante au sel. Donc, la vigueur des variétés de vigne étudiées sur franc de pied ne semble plus être un paramètre ni un critère de tolérance à la salinité comme il a été démontré par nos travaux sur les porte-greffes (Hamrouni 2009).
3.2.2. Nombre de feuilles et surface foliaire
Le nombre de feuilles développées en fin de test au sein des variétés étudiées est variable : il se situe aux alentours de 120 pour les variétés Razegui, Superior Seedless et Asli, et en deçà de 80 pour les autres (figure 3). Mais ce paramètre est sévèrement réduit par le stress salin (100 mM NaCl) sauf pour la variété tolérante Cardinal qui n’affiche pas de réduction significative. Autrement, dans la plupart des cas, cette réduction peut atteindre 50 % particulièrement chez les variétés sensibles Asli et Syrah. L’effet dépressif du sel sur le nombre de feuilles est donc remarquable chez les variétés de vigne cultivées sur franc de pied. Ainsi, le nombre de feuilles est un paramètre très sensible à la salinité chez les variétés de vigne. La surface foliaire se situe aux alentours de 200 cm2, elle est réduite par le stress salin pour les variétés les plus sensibles telles que Syrah, Asli et Muscat d’Italie, mais ne varie pas de manière significative pour les variétés tolérantes (Cardinal et Superior Seedless). Le pourcentage de réduction de la surface sous l’effet du stress salin est d’environ 50 % pour la variété Asli (sensible), alors que chez Cardinal (tolérante) cette diminution est très faible elle est de l’ordre de 12 %. Concernant la surface foliaire totale, celle-ci est également réduite suite au stress salin sauf pour la variété tolérante Cardinal. On constate de nouveau que la variété Razegui sous stress salin affiche les mêmes performances au niveau de la surface foliaire totale que les variétés témoins Cardinal, Muscat d’Italie et Syrah.
|
Figure 3 : Effet du stress salin (NaCl 100 mM) sur le nombre de feuilles des variétés de vigne. Moyennes de 13 répétitions. Les valeurs suivies de la même lettre ne sont pas significativement différentes (Classement des moyennes selon le test de Duncan, α = 0.05).
|
3.3. Teneur en chlorophylle totale
Les teneurs en chlorophylle foliaire diminuent chez toutes les variétés étudiées sauf Razegui et Cardinal ; et en termes de quantité de chlorophylle, seule la variété Cardinal n’est pas affectée par le traitement salin, prouvant davantage son caractère de tolérance à la salinité (tableau 1). Les variétés Asli et Syrah présentent les plus faibles teneurs en chlorophylle suite à l’application du traitement salin. Il semble donc que le maintien d’un niveau élevé des teneurs en chlorophylle foliaire soit un caractère important pour l’adaptation au stress salin.
|
Tableau 1 : Effet du sel (NaCl 100 mM) sur la teneur en chlorophylle foliaire totale (μg/g MF) chez les variétés de vigne. Moyennes de 13 répétitions (* : effet significatif au seuil de α = 0.05, comparaison des moyennes par le test Duncan). |
||||||
|
Variété Traitement |
Muscat d’Italie |
Asli |
Superior seedless |
Razegui |
Cardinal |
Syrah |
|
Témoin |
26.5 |
24.5 |
23 |
21.5 |
19.5 |
18.5 |
|
Traité |
22* |
15* |
18.5* |
22 |
20 |
14.9* |
3.4. Statut hydrique
Concernant la teneur en eau des plantes, les résultats obtenus révèlent une certaine stabilité de ce paramètre pour chaque variété. En effet, aucune variation significative de teneur en eau n’est enregistrée chez les variétés de vigne suite au stress salin.
3.5. Nutrition minérale des plantes
3.5.1. Effet du NaCl sur l’accumulation du sodium
Suite à l’application du traitement salin, une grande variabilité de comportement est observée selon la variété et l’organe (figure 4). Au niveau des feuilles, toutes les variétés analysées augmentent leur concentration en sodium suite au traitement salin. La variété la plus sensible Syrah affiche la plus forte concentration foliaire de sodium soit près de 1300 μmol/g MS. Cette concentration de sodium au niveau des feuilles de la variété Syrah est très élevée, elle dépasse toutes les valeurs que nous avons enregistré au niveau des feuilles de tous les génotypes analysés, elle semble donc toxique et létale pour la plante qui ne parvient pas à y faire face par les différents mécanismes de tolérance (ajustement osmotique, compartimentation vacuolaire, recirculation du sodium et exclusion hors du compartiment aérien…). Il en est de même pour la variété Asli, pour laquelle les travaux de Hanana (2008) ont montré que celle-ci est incapable de réaliser la compartimentation vacuolaire du sodium suite au même type de stress salin (100 mM NaCl) étant donné qu’aucune élévation de l’expression du gène VvNHX1 (responsable de la compartimentation vacuolaire du sodium) n’a été détectée par Northern Blot, alors qu’une induction d’expression de ce gène a été mise en évidence chez la variété Razegui (moyennement tolérante). Or, l’induction de l’expression des gènes NHX en tant que réponse à l’application d’un stress osmotique ou salin a été décrite chez diverses espèces (Fukuda et al. 2004; Verma et al. 2007; Queiros et al. 2009). Donc bien que le sodium soit accumulé au niveau des feuilles des variétés Syrah et Asli, celles-ci ne peuvent réagir de façon efficace pour y palier. Selon Stevens and Walker (2001), un engorgement transitoire peut aussi provoquer dans les feuilles des concentrations en Na+ plus élevées que la moyenne dans certaines situations. Le stress salin induit également une nette augmentation de concentration de sodium au niveau de la tige, sauf chez la variété Syrah où celle-ci ne varie pas. Au niveau des racines, seules les variétés Cardinal, Muscat d’Italie et Razegui affichent une augmentation significative de leur concentration en sodium suite au traitement salin, les autres variétés ne présentent pas d’augmentation significative de leur concentration de sodium. Ainsi, les variétés Syrah et Asli ne changent pas leur concentration de sodium au niveau des racines mais plutôt au niveau des feuilles, d’où le comportement ‘includer’ de ces variétés sensibles. Par contre, les variétés tolérantes, en l’occurrence Cardinal, Superior Seedless et aussi Razegui, adoptent un comportement ‘excluder’ puisqu’elles accumulent énormément de sodium au niveau de leurs racines. On constate aussi que ces variétés tolérantes concentrent la plus grande partie du sodium foliaire accumulé au niveau des feuilles basales qui exercent un effet de dilution contrairement à celles des variétés sensibles. Le mécanisme d’exclusion des ions sodium chez la vigne est encore mal compris mais est sans doute similaire au mécanisme présent dans les agrumes, qui semble fonctionner par un retrait de Na+ depuis le xylème jusqu’aux parties inférieures de la plante et la séquestration dans les cellules des racines et des troncs ligneux (Walker 1986). Selon Garcia and Charbaji (1993), ce sont les variétés tolérantes qui accumulent le moins de sodium
|
Figure 4 : Effet du stress salin (NaCl 100 mM) sur la teneur en sodium des organes des variétés de vigne. Moyennes de 13 répétitions. Les valeurs suivies de la même lettre ne sont pas significativement différentes (Classement des moyennes selon le test de Duncan, α = 0.05). |
3.5.2. Effet du NaCl sur l’accumulation du chlore
Les concentrations en chlore enregistrées après l’application du stress salin augmentent partout dans la plante et pour toutes les variétés (figure 5). Les valeurs de concentration les plus élevées sont enregistrées chez Muscat d’Italie, Asli puis Syrah. Ces dernières étant des variétés sensibles, cela montre que le chlore exerce aussi un effet toxique sur les variétés de vigne. Par contre, les variétés tolérantes telles que Cardinal et Superior Seedless parviennent à maintenir les plus faibles teneurs en chlore au niveau de leurs différents organes, leur permettant ainsi d’éviter ou du moins de réduire sa toxicité. Le comportement des variétés tolérantes de vigne vis-à-vis du chlore est comparable à celui des porte-greffes tolérants (Hamrouni 2009). Notons aussi, comme pour les porte-greffes, que les µmol/g MS pour les plants traités. La majorité des variétés étudiées adoptent un comportement d’exclusion du chlore vers les racines, exceptées les variétés Cardinal et Syrah. Les travaux de Storey et al. (2003) ont aussi démontré que les racines de vigne servent à la compartimentation et à l’accumulation des ions chlorures. Ces résultats confirment de nouveau que le chlore est un ion très toxique pour la vigne. Les variétés tolérantes Cardinal, Superior Seedless et Muscat d’Italie concentrent également, comme pour le sodium, la plus grande partie des chlorures foliaires accumulés au niveau des feuilles basales en exerçant aussi un effet de dilution afin de réduire leur toxicité.
|
Figure 5 : Effet du stress salin (NaCl 100 mM) sur la teneur en chlore des organes des variétés de vigne. Moyennes de 13 répétitions. Les valeurs suivies de la même lettre ne sont pas significativement différentes (Classement des moyennes selon le test de Duncan, α = 0.05). |
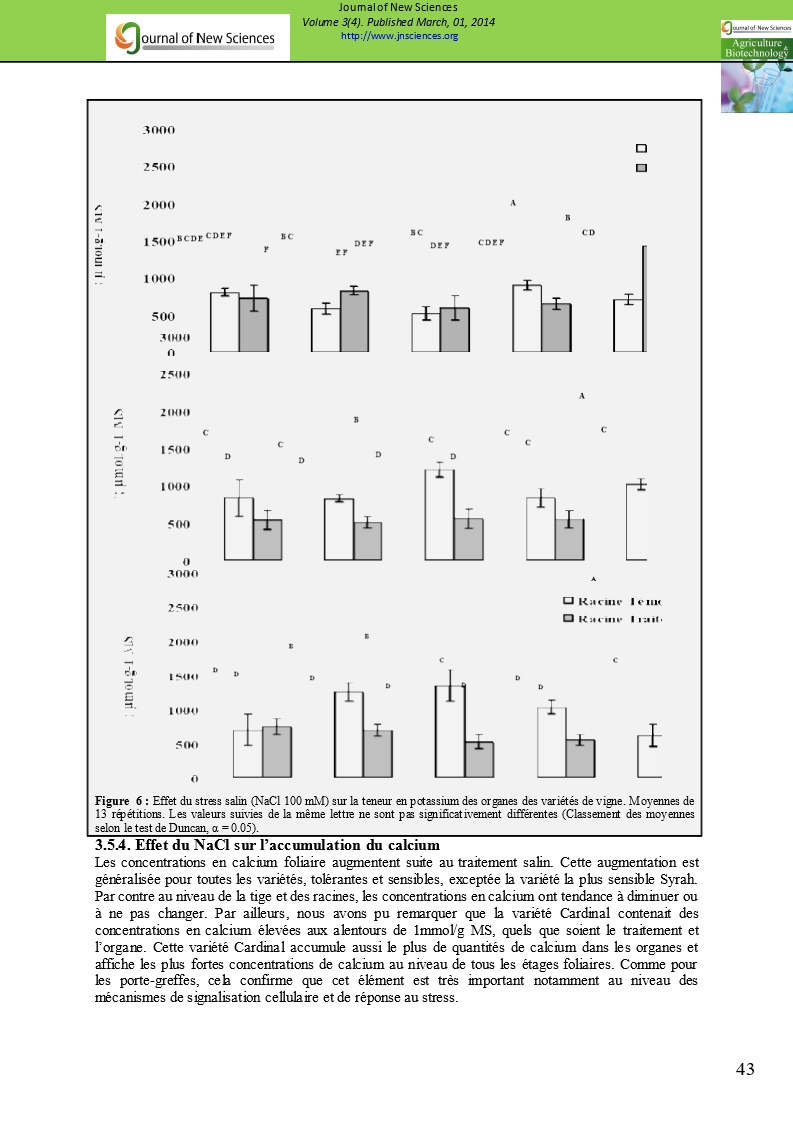
3.5.3. Effet du NaCl sur l’accumulation du potassium
L’effet du traitement salin sur les concentrations en potassium est variable selon l’organe et la variété (figure 6). Dans la majorité des cas, les concentrations diminuent sauf dans le cas particulier des feuilles de la variété tolérante Cardinal qui affichent une augmentation de la concentration en potassium, jouant ainsi le rôle dans l’ajustement osmotique. Par ailleurs les concentrations de potassium foliaire ne changent pas de manière significative sauf chez la variété sensible Syrah où elle diminue et ne parvient donc pas à assurer l’ajustement osmotique pour pouvoir faire face au stress salin. D’autre part, les concentrations de potassium baissent significativement au niveau de la tige et des racines de toutes les variétés sauf chez la variété tolérante Cardinal qui maintient des concentrations identiques aux témoins (figure 6). Les quantités de potassium accumulé dans les différents organes suite au traitement salin chutent pour toutes les variétés sauf au niveau des feuilles de la variété Cardinal où les quantités de potassium augmentent, en signe d’adaptation et de régulation osmotique. Seule la variété Cardinal a été capable de réaliser ce mécanisme de tolérance et d’adaptation à l’entrée massive des ions Na+ et Cl- au niveau de ses tissus. La concentration en potassium dans la plante semble donc être un élément important dans la détermination de l’adaptation et de la tolérance de la vigne à la salinité. La plante qui parvient donc maintenir un niveau adéquat de potassium dans ses tissus et dans ses organes (feuilles surtout) assure sa protection contre la toxicité par NaCl. Il a été démontré que le stress salin induisait une réduction de l’absorption de potassium chez la vigne, mais dans certaines conditions cela peut ne pas être aperçu en raison de concentrations initiales déjà élevées dans la solution d’irrigation (Paranychianakis et al. 2006).
|
Figure 6 : Effet du stress salin (NaCl 100 mM) sur la teneur en potassium des organes des variétés de vigne. Moyennes de 13 répétitions. Les valeurs suivies de la même lettre ne sont pas significativement différentes (Classement des moyennes selon le test de Duncan, α = 0.05). |
3.5.4. Effet du NaCl sur l’accumulation du calcium
Les concentrations en calcium foliaire augmentent suite au traitement salin. Cette augmentation est généralisée pour toutes les variétés, tolérantes et sensibles, exceptée la variété la plus sensible Syrah. Par contre au niveau de la tige et des racines, les concentrations en calcium ont tendance à diminuer ou à ne pas changer. Par ailleurs, nous avons pu remarquer que la variété Cardinal contenait des concentrations en calcium élevées aux alentours de 1mmol/g MS, quels que soient le traitement et l’organe. Cette variété Cardinal accumule aussi le plus de quantités de calcium dans les organes et affiche les plus fortes concentrations de calcium au niveau de tous les étages foliaires. Comme pour les porte-greffes, cela confirme que cet élément est très important notamment au niveau des mécanismes de signalisation cellulaire et de réponse au stress.
3.5.5. Effet du NaCl sur l’accumulation du magnésium
Les teneurs en magnésium ne semblent pas être affectées ni modifiées de manière significative par la salinité et les modifications de concentration de magnésium affichée par certaines variétés et au niveau de certains organes ne semblent pas signifier un rôle très important concernant la tolérance à la salinité. Les teneurs en magnésium foliaire ont légèrement augmenté chez la variété Sultanine après deux saisons d’irrigation avec une eau de recyclage chargée en sels (Paranychianakis et al. 2006).
3.5.6. Rapport K+/Na+
Suite au traitement salin, le rapport K/Na diminue au niveau de tous les organes et chez toutes les variétés sans exception. Cette diminution est plus accentuée au niveau de la partie aérienne de la plante. La diminution de ce rapport est d’autant plus importante que la variété est sensible, plus particulièrement au niveau de la partie aérienne. La variété Cardinal est celle qui affiche les plus légères réductions de ce rapport. D’après Storey et al. (2003), les racines de vigne stressée affichent un profil de distribution ionique particulier. Au niveau des cellules de l’épiderme, les vacuoles contiennent des teneurs élevées en K+ et faibles en Na+ ; toutefois en traversant le parenchyme cortical jusqu’à l’endoderme cette répartition s’inverse et le sodium s’accumule de plus en plus dans la vacuole, et cela se poursuit en s’accentuant jusqu’au niveau du péricycle. Cette étude met ainsi en évidence l’importance non seulement du rapport K/Na au niveau des différents tissus racinaires, de l’accumulation du sodium dans les racines mais aussi et surtout de sa compartimentation vacuolaire.
4. Discussion
Chez toutes les espèces végétales, glycophytes comme halophytes, la salinité du milieu entraîne, à partir d’un certain seuil, une réduction de biomasse. Néanmoins, le degré d’inhibition de la croissance dépend du genre, de l’espèce, de la variété, ainsi que du stade du développement de la plante et de la nature de l’organe (Shannon and Noble 1995). Evaluée sur l’ensemble du cycle du développement, la vigne est considérée comme une plante modérément sensible au NaCl (Maas 1990). L’action dépressive du sel se manifeste par une réduction de la production de matière sèche des différents organes de la plante (Shani and Ben-Gal 2005). Les dégâts foliaires (Munns 1993), la hauteur (Noble and Rogers 1992) et la croissance relative des plants (Cramer and Bowman 1991) figurent parmi les paramètres utilisés pour l’étude de la tolérance à la salinité et de l’adaptation des plantes au stress salin. Les effets néfastes des sels se manifestent au niveau de la plante entière, mais ils sont plus perceptibles sur les feuilles (Rochdi et al. 2005). Selon Arrandeau (1989), la réduction de la surface foliaire pourrait correspondre à une forme d’adaptation à la salinité, car ce comportement tend à minimiser les pertes d‘eau par transpiration, mais, en contre partie, elle peut aussi provoquer une diminution du rendement à cause de la réduction de la capacité photosynthétique (Bidinger and Witcombe 1989). La résistance aux dégâts foliaires, comme critère de comparaison, est basée sur le fait que l’absence de la chlorose est généralement indicatrice des variétés les plus aptes à exclure les sels. Les variétés de vigne étudiées présentent une diversité de comportement vis-à-vis de la contrainte saline. A cet effet, la sensibilité au sel de la vigne est liée à l’aptitude du génotype à tolérer le NaCl dans les feuilles, particulièrement dans les plus jeunes d’entres elles (Lachâal et al. 1997). L’étude du comportement de la vigne en conditions de stress salin montre que le sel affecte plus la croissance des racines que celles des parties aériennes. Cette différence de sensibilité au sel entre les deux types d’organes apparaît clairement à l’examen du rapport Partie aérienne/Partie racinaire. Cette sensibilité du système racinaire est l’une des caractéristiques de la sensibilité, car généralement ce sont les organes photosynthétiques qui manifestent une plus forte sensibilité au stress salin que les organes d’absorption (Brugnoli and Björkman 1992). La sensibilité au stress salin observée au niveau du système racinaire de la vigne se traduit par une baisse au niveau de l’activité de biosynthèse, d’autant plus importante que la salinité du substrat est plus élevée. L’effet dépressif de la salinité sur la croissance des plantes peut avoir deux causes principales non exclusives: les difficultés d’alimentation en eau et en nutriments, et la toxicité des ions accumulés en excès dans la plante (Xiong and Zhu 2002). Nos résultats suggèrent que la réduction de matière sèche observée suite à l’addition de NaCl dans la solution d’arrosage reviendrait à l’action défavorable de Na+ (et Cl-) accumulé(s) dans les tissus. Mais, cette accumulation massive de Na+ dans les tissus foliaires est accompagnée par une diminution des teneurs en K+. Il est bien établi que la présence de Na+ et Cl- en grande quantités dans le milieu de culture entraîne une compétition au niveau des sites d’absorption de K+, Ca2+ et NO3- (Martinez and Laüchli 1993), se manifestant par la limitation de l’absorption de ces éléments nutritifs essentiels. Hajji (1983), dans ses travaux sur le laurier rose, montre que l’effet néfaste du sel sur la production de biomasse provient davantage d’une inhibition de l’alimentation de la racine en K+ et Ca2+, lorsque le milieu de culture contient des quantités importantes de NaCl, que de l’accumulation de sel dans la plante. Chez les végétaux, et plus particulièrement chez les céréales, le maintien d’une bonne sélectivité K/Na dans les tissus peut être considéré comme un critère de tolérance à la salinité (Hauser and Horie 2010). Dans leurs travaux sur l’orge, Greenway and Munns (1980) montrent que le cultivar tolérant possède une plus grande sélectivité pour K+ que pour Na+ que le cultivar sensible. Shannon and Noble (1995) montrent que la tolérance de certains cultivars de trèfles est associée à une limitation du transport de Na+ vers les organes aériens et au maintien d’une sélectivité K/Na élevée (Hauser and Horie 2010). Les mécanismes d’exclusion du sodium et de maintien d’un rapport K/Na élevé chez les plantes seraient assurées par la famille des gènes HKT (Hauser and Horie 2010; Cotsaftis et al. 2012). Chez la vigne, l’examen de la relation entre l’indice de sensibilité et le rapport K/K+Na révèle que la tolérance à NaCl de Vitis vinifera est corrélée positivement à la performance des plantes à prélever K+ tout en limitant l’accumulation de Na+. Paradoxalement, les porte-greffes de vigne tolérant, notamment le 140R, affichent un comportement d’inclusion et d’accumulation des ions sodium au niveau des parties aériennes (Hamrouni 2009). Chez les glycophytes, certaines espèces adoptent le comportement d’exclusion du sodium de leur partie aérienne et maintiennent ainsi des niveaux de sel relativement bas dans les tissus photosynthétiques ; tandis que d’autres, transportent et accumulent le sodium dans leurs feuilles. Ces deux comportements opposés traduisent un paradoxe apparent : en effet, le premier, qui correspond à une protection des organes aériens contre l’envahissement par le NaCl, s’observe chez les glycophytes les plus sensibles au sel ; le second, qui autorise l’accumulation de NaCl dans les feuilles, est caractéristique des espèces les plus résistantes. Ainsi, ce sont les espèces qui paraissent à priori les mieux armées pour protéger leur appareil photosynthétique de l’invasion du sel qui supportent le moins bien l’agression saline (Zid and Grignon 1991). En fait, il existe deux stratégies opposées concernant la distribution et la compartimentation des sels, les plantes dites includers, capables d’accumuler des quantités élevées d’ions au niveau de leur partie aérienne, et celles dites excluders, évacuant de la partie aérienne et stockant les sels dans leurs racines (O’Leary 1995). Les espèces incapables de transporter facilement le sodium dans leurs feuilles sont nettement plus sensibles que les autres, car leur inaptitude à exporter le sodium est probablement moins un caractère protecteur que le reflet d’une déficience des systèmes de compartimentation cellulaire (Slama 1982). En effet, ces espèces semblent peu efficaces pour abaisser le niveau cytoplasmique du sodium, ce qui est peut-être l’une des causes profondes de leur sensibilité au niveau cellulaire. Mais l’incapacité à débarrasser le cytoplasme du sodium a pour conséquence que cet ion est facilement transporté dans le phloème chez ces plantes. Il est donc continuellement ramené vers le bas de la plante, ce qui se traduit par le comportement classique d’exclusion (Levigneron et al. 1995). Ainsi, la tolérance au sel est d’autant meilleure que moins de sodium est exporté vers les parties aériennes (Moller et al. 2009). La seconde catégorie d’espèces (dites includers) associe la résistance à la salinité et l’aptitude à transporter de grandes quantités de NaCl dans les feuilles (Levigneron et al. 1995). Il semble que ce comportement résultent d’une bonne compartimentation cellulaire du sodium au sein de la vacuole, particulièrement via l’action d’un antiport de type NHX (Hanana et al. 2007; 2009), ce qui explique la tolérance à l’accumulation foliaire, et aussi la faible conduction de cet ion dans le phloème. Mais ce schéma de tolérance suppose évidemment un contrôle des quantités accumulées dans les feuilles, qui ne doivent pas perturber l’équilibre osmotique. Néanmoins, il existe des exceptions à la règle de l’association entre l’importance du transport de Na+ dans les feuilles et le degré de tolérance dans les comparaisons d’espèces. Au niveau variétal, la corrélation entre la tolérance et l’aptitude à limiter le transport de Na+ dans les feuilles est bien illustrée chez le riz. Ce dernier est considéré comme la plus sensible des céréales à la salinité. En effet, des concentrations de NaCl aussi faibles que 50 mM provoquent chez le riz une certaine mortalité et réduisent de moitié le rendement en grain (Maas and Hoffman 1976). L’analyse de différents niveaux foliaires, chez quatre variétés de riz, montre que les variétés les plus résistantes au sel sont celles qui compartimentent Na+ dans les vieilles feuilles, protégeant ainsi les jeunes feuilles contre les effets nocifs de ce cation, comme cela a été le cas pour la variété Cardinal de vigne. Les variétés sensibles, en revanche, laissent rapidement envahir par Na+ leurs jeunes feuilles en croissance (Yeo and Flowers 1982). Récemment, chez le riz, un modèle proposé par Cotsaftis et al. (2012) éclaircit la stratégie cellulaire de l’exclusion du sodium en se basant sur la régulation spatio-temporelle de la transcription, l’épissage alternatif ainsi que la structure protéique des gènes HKT. L’exclusion des chlorures est aussi un comportement commun aux porte-greffes de vigne résistants (Hamrouni 2009; Fort et al. 2013). D’autre part, chez un certain nombre d’espèces cultivées telles que les Citrus, la résistance au sel est également associée à l’exclusion de Cl- des parties aériennes (Teakle and Tyerman 2010). Enfin, nos résultats s’ajoutent à ceux de Toumi et al. (2007) démontrant également que la variété Cardinal cultivée sur franc de pied était tolérante au stress hydrique.
5. Conclusion
Ainsi, d’après nos résultats d’analyse, il s’est avéré que le comportement de tolérance des variétés de vigne, parmi les six étudiées, ne soit pas lié à leur vigueur (contrairement aux porte-greffes). En effet, les variétés les plus vigoureuses, en l’occurrence Razegui et Asli, ne sont pas les plus tolérantes, et de même, les variétés moyennement ou peu vigoureuses telle que Cardinal, ne sont pas forcément sensibles. Suite à ces résultats obtenus, nous pouvons représenter un classement du niveau de tolérance à la salinité des variétés de vigne :
Cardinal > Superior Seedless > Muscat d’Italie > Razegui > Asli > Syrah
Nous pouvons conclure aussi que le nombre de feuilles, la surface foliaire et la teneur en chlorophylle sont des caractères importants pour l’adaptation des variétés de vigne au stress salin. Ce travail met en évidence, les incidences du facteur sel sur l’expression des potentialités de la culture de vigne en conditions expérimentales. Chez les variétés de vigne étudiées, les fortes accumulations foliaires de Na+, en particulier chez Cardinal relèvent d’un comportement de tolérance à la salinité qui, d’après notre étude se révèle étroitement corrélé au maintien de l’activité photosynthétique ainsi qu’à son aptitude à exclure le sodium au niveau de la partie racinaire (comportement dit ‘excluder’ vis-à-vis du sodium), à restreindre l’entrée et le stockage des chlorures au niveau des tissus végétaux (comportement excluder vis-à-vis des chlorures), et à sa capacité de transférer et accumuler le potassium au niveau des feuilles pour réaliser l’ajustement osmotique, mais aussi en premier lieu à faire intervenir les mécanismes de signalisation de stress via l’augmentation des teneurs en calcium au niveau des feuilles (et surtout les feuilles apicales jeunes). Néanmoins, notre étude ouvre la porte vers de nouvelles questions, notamment sur le comportement de ces variétés lorsqu’elles seraient greffées sur des porte-greffes adoptant des stratégies totalement opposées (inclusion) ou même similaires (exclusion), quel serait alors le phénotype obtenu des différentes combinaisons et sur quels mécanismes génétiques (dominance, synergie entre les génotypes scion/porte-greffe) cela repose-t-il ? Des questions auxquelles nous ne possédons pas encore tous les éléments de réponse, du moins à ce stade de notre étude.
6. Références
Abdelly C (1997) Mécanismes d’une association de luzernes spontanées et de halophytes pérennes en bordure de sebkha. Thèse de doctorat d’État : Université Tunis II, Faculté des Sciences de Tunis (Tunisie).
Arnon DI, Hoagland DR (1940) Crop production in artificial solutions and soils with special reference to factors influencing yield and absorption of inorganic nutrients. Soil Sci, 50: 463-471.
Arnon D (1941) Copper enzymes in isolated chloroplasts: Polyphenoloxydase in Beta vulgaris. Plant Physiol, 24: 1-15.
Arrandeau M (1989) Breeding strategies for drought. Baker, F.W.G. (éd.). Cab International, Wallingford, pp. 107-116.
Bidinger FR, Witcombe JR (1989) Evaluation of specific drought avoidance traits as selection criteria. In : Baker, F.W.G. (Ed), Drought Resistance in Cereals – Theory and Practice. ICSU Press, Paris, pp 151-164.
Brugnoli E, Björkman O (1992) Growth of cotton under continuous salinity stress: influence on allocation pattern, stomatal and non-stomatal components and dissipation of excess light energy. Planta, 187: 335-347.
Bruinsma J (1961) Comment on the spectrophotometric determination of chlorophyll. Biochim Biophys Acta, 52: 576-578.
Champagnol F (1984) Eléments de physiologie de la vigne et de viticulture générale. Champagnol, St-Gely-du-Fesc, pp. 351.
Cotsaftis O, Plett D, Shirley N, Tester M, Hrmova M (2012) A Two-Staged Model of Na+ Exclusion in Rice Explained by 3D Modeling of HKT Transporters and Alternative Splicing. PlosOne, 7(7): 1-10.
Cramer GR, Bowman DC (1991) Kinetics of maize leaf elongation. I. Increased yield threshold limits short-term, steady-state elongation rates after exposure to salinity. J Exp Bot, 42: 1417-1426.
Fort KP, Kristin M, Lowe KM, William A, Thomas WA, Walker MA (2013) Cultural Conditions and Propagule Type Influence Relative Chloride Exclusion in Grapevine Rootstocks. Am J Enol Vitic, 64 (2): 241-250. doi: 10.5344/ajev.2013.12073.
Fukuda A, Nakamura A, Akemi Tagiri A, Tanaka H, Miyao A, Hirochika H, Tanaka Y (2004) Function, Intracellular Localization and the Importance in Salt Tolerance of a Vacuolar Na+/H+ Antiporter from Rice. Plant Cell Physiol, Vol. 45, No. 2: 146-159.
Garcia M, Charbaji T (1993) Effect of sodium chloride salinity on cation equilibria in grapevine. J Plant Nutr, 16: 2225-2237.
Greenway H, Munns R (1980) Mechanisms of salt tolerance in non-halophytes. Annu Rev Plant Physiol, 31: 149-190.
Hajji M (1983) Mécanismes des effets du milieu sale sur la nutrition minérale d’une plante ripicole : interaction des transports d’ions et d’eau chez le laurier rose. Thèse Doctorat d’Etat. Tunis, 278p.
Hamrouni L (2009) Evaluation de la tolérance au sel chez la vigne en Tunisie. Thèse de Doctorat, Faculté des Sciences de Tunis, Tunisie, pp. 230.
Hanana M (2008) Identification, caractérisation et analyse fonctionnelle d’un antiport vacuolaire de type NHX chez la vigne. Thèse de Doctorat de l’ENIS pour l’obtention du diplôme de Docteur en Génie Biologique (option : Génie Biologique), Tunisie, 187pp.
Hanana M, Cagnac O, Yamaguchi T, Hamdi S, Ghorbel A, Blumwald E (2007) A Grape Berry (Vitis vinifera L.) Cation/Proton Antiporter is Associated with Berry Ripening. Plant Cell Physiol, 48(6): 804-811.
Hanana M, Cagnac O, Zarrouk M, Blumwald E (2009) Rôles biologiques des antiports vacuolaires NHX : acquis et perspectives d’amélioration génétique des plantes. Botany, 87: 1023-1035.
Hauser F, Horie T (2010) A conserved primary salt tolerance mechanism mediated by HKT transporters: a mechanism for sodium exclusion and maintenance of high K+/Na+ ratio in leaves during salinity stress. Plant, Cell Env, 33: 552-565.
Hewitt EJ (1952) Sand water culture methods used in the study of plant nutrition. Commonwealth Agricultural Bureau Technical communication, No. 22.
Jacobson L (1951) Maintenance of iron supply in nutrient solutions by a single addition of ferric potassium ethylenediamine tetraacetate. Plant Physiol, 26: 411-413.
Lachâal M, Abdelly C, Sleimi N (1997) Recherche de critères physiologiques pour le tri de plantes tolérantes au sel. Dans : 6èmes Journées Scientifiques du Réseau Biotechnologies Végétales. AUPELF-UREF, Orsay.
Läuchli A (1984) Salt exclusion : an adaptation of legumes for crops and pastures under saline conditions. In : Staples RC, Toennienssen GA eds. Salinity Tolerance in Plants. Strategies for Crop Improvement. Wiley, New York, pp. 171-187.
Legros JP (2005) Les Américanistes du Languedoc 1868-1893. Etudes et gestions des sols, 12 (2): 165-186.
Levigneron A, Lopez F, Vansuyt G, Berthomieu P, Fourcroy P, Casse-Delbart F (1995) Les plantes face au stress salin. Cahiers Agric, 4: 263-273.
Maas EV, Hoffman GJ (1976) Crop salt tolerance : evaluation of existing data. In : Managing Saline Water for Irrigation. Degre HE Ed. Proc. Int. Conf., Texas Technical University, 187-198.
Maas EV (1990) Crop salt tolerance. In Agricultural salinity assessment and management. American Society of Civil Engineers: New York. Ed. Tanji KK. pp 262–304.
Martinez V, Läuchli A (1993) Effects of Ca2+ on the salt-stress responses of barley roots as observed by in-vivo 31P-nuclear magnetic resonance and in-vitro analysis. Planta, 190: 519-524.
Moller IS, Gilliham M, Jha D, Mayo GM, Roy SJ, Coates JC, Haseloff J, Tester M (2009) Shoot Na+ Exclusion and Increased Salinity Tolerance Engineered by Cell Type–Specific Alteration of Na+ Transport in Arabidopsis. Plant Cell, 21: 2163-2178.
Munns R (1993) Physiological processes limiting plant growth in saline soils: some dogmas and hypotheses. Plant, Cell Env, 16: 15-24.
Noble CL, Rogers ME (1992) Arguments for the use of physiological criteria for improving the salt tolerance in crops. Plant Soil, 146: 99-107.
O’Leary JW (1995) Adaptive components of salt tolerance. In : Pessarakli M (Ed) Handbook of plant and crop physiology. Marcel Dekker, Inc., NY, pp. 577-585.
Ollat N, Decroocq S, Bouquet A (2009) Grapevine rootstock genetic improvement: current global research. Genomics and grapevine improvement, New opportunities for the wine business. Lien de la Vigne, Annual Assembly of the association, March 13, 2009. Abstract report, p.1.
Paranychianakis NV, Nikolantonakis M, Spanakis Y, Angelakis AN (2006) The effect of recycled water on the nutrient status of Soultanina grapevines grafted on different rootstocks. Agric Water Manag, 81: 185-198.
Queiros F, Fontes N, Silva P, Almeida D, Maeshima M, Geros H, Fidalgo F (2009) Activity of tonoplast proton pumps and Na+/H+ exchange in potato cell cultures is modulated by salt. J Exp Bot, 60(4): 1363-1374.
Rochdi A, Lemsellek J, Bousarhal A, Rachidai A (2005) Évaluation sous serre de la tolérance à la salinité de quelques porte-greffes d’agrumes : Citrus aurantium et deux hybrides de Poncirus trifoliata (Poncirus x Citrus sinensis et Poncirus x Mandarinier sunki). Biotechnol Agron Soc Environ, 9(1): 65-73.
SAS (1988) Institute, Inc. SAS/GRAPH User's Guide, Release 6.03 Edition. Cary, NC: SAS Institute Inc.,. 549 pp.
Shani U, Ben-Gal A (2005) Long-term Response of Grapevines to Salinity: Osmotic Effects and Ion Toxicity. Am J Enol Vitic, 56: 148-154.
Shannon MC, Noble CL (1995) Variation in salt tolerance and ion accumulation among subterranean clover cultivars. Crop Sci, 35: 788-804.
Slama F (1982) Effet du chlorure de sodium sur la croissance et la nutrition minérale : étude comparative de 6 espèces cultivées. Thèse de Doctorat d’Etat. Tunis, pp.214.
Stevens RM, Walker RR (2001) Response of grapevines to irrigation induced saline-sodic soil conditions. Aust J Exp Agri, 42(3): 323-331.
Storey R, Schachtman DP, Thomas MR (2003) Root structure and cellular chloride, sodium and potassium distribution in salinized grapevines. Plant Cell Env, 26: 789-800.
Teakle NL, Tyerman SD (2010) Mechanisms of Cl- transport contributing to salt tolerance. Plant Cell Env, 33: 566-589.
Toumi I, M’Sehli W, Bourgou S, Jallouli N, Bensalem-Fnayou A, Ghorbel A, Mliki A (2007) Response of ungrafted and grafted grapevine cultivars and rootstocks (Vitis sp.) to water stress. Int J Vine Wine Sci, 41(2): 85-93.
Verma D, Singla-Pareek SL, Rajagopal D, Reddy MK, Sopory SK (2007) Functional validation of a novel isoform of Na+/H+ antiporter from Pennisetum glaucum for enhancing salinity tolerance in rice. J Biosci, 32: 621-628.
Walker RR (1986) Sodium exclusion and potassium-sodium selectivity in salt-treated Trifoliate Orange (Poncirus trifoliata) and Cleopatra mandarin (Citrus reticulata) plants. Aust J Plant Physiol, 13: 293-303.
Xiong L, Zhu JK (2002) Regulation of osmotic stress-responsive gene expression by the LOS6/ABA1 locus in Arabidopsis. J Biol Chem, 277: 8588-8596.
Yeo AR, Flowers TJ (1982) Accumulation and localisation of sodium ions within the shoots of rice (Oryza sativa) varieties differing in salinity resistance. Physiol Plant, 56: 346-348.
Zid E, Grignon C (1991) Les tests de sélection précoce pour la résistance des plantes au stress. Cas des stress salin et hydrique. Dans : L’Amélioration des Plantes pour l’Adaptation aux Milieux Arides. Ed. AUPELF-UREF, John Libbey Eurotext, Paris, pp. 91–108.

