
- Category: Volume 4
- Hits: 12821
Activités biologiques des huiles essentielles de pins
M. Hanana
A. Bejia 2
I. Amri 3
S. Gargouri 4
B. Jamoussi 5
L. Hamrouni 2
1 Centre de Biotechnologie de Borj-Cédria. Laboratoire de Physiologie moléculaire des Plantes. BP 901. TN-2050 Hammam-lif (Tunisie).
2 Institut National de Recherche en Génie Rural, Eaux et Forêts. Laboratoire d’Écologie Forestière. BP 10. TN-2080 Ariana, Tunisie.
3 Faculté des Sciences de Bizerte. TN-7021 Bizerte, Tunisie.
4 Institut National de la Recherche Agronomique de Tunisie, Laboratoire de Protection des Végétaux, TN-2080 Ariana, Tunisie.
5 Institut Supérieur d’Education et de Formation Continue. Laboratoire de Chimie.. TN-2000 Le Bardo, Tunisie.
Summary - In the frame of pine conservation and valorization program in Tunisia, we performed a research action focused on potential properties of essential oils of three pine species: Pinus brutia, Pinus coulteri and Pinus caribaea. In a first attempt, we proceeded to needle essential oil extraction using hydrodistillation and analyzed their chemical composition by gas chromatography coupled to mass spectrometry. In order to analyze their herbicidal and antifungal activities, we performed in/ex vitro culture tests of fungi and weeds submitted to treatments with different essential oil concentrations. Chemical composition analysis of the essential oils revealed that each species had specific components but often similar as α-pinene which is a major compound. In other hand, some components are only present within some species, such as manoyl oxide (25.2%) forP. caribaea and (E)-calamanene (15.2%) for P. coulteri. The study of the herbicidal activities of these essential oils against the tested species (Sinapis arvensis L., Phalaris canariensis L. and Triticum turgidum L.) showed a noteworthy inhibitory effect on their germination and growth. The study of the antifungal activity on several phytopathological strains (Fusarium avenaceum, Fusarium solani, Fusarium oxysporum, Botrytis cinerea and Bipolaris sorokiniana) revealed that these oils could inhibit the fungal growth, nevertheless, this effect is less pronounced than the herbicidal action. These potential antifungal and herbicidal activities need to be validated within cultivated crops and their impact on environment before being able to suggest and prepare a biopesticide formula based on pine essential oils.
Keywords : antifungal / herbicide / essential oil / pine.
Résumé - Dans le cadre d’un programme de conservation et de valorisation du pin en Tunisie, nous avons entrepris une action de recherche sur les potentielles propriétés antifongiques et herbicides des huiles essentielles de trois espèces de pin : Pinus brutia, Pinus coulteri et Pinus caribaea. En premier lieu, nous avons procédé à l’extraction des huiles essentielles par hydro-distillation des aiguilles et analysé leur composition chimique à l’aide de la chromatographie en phase gazeuse couplée à la spectrométrie de masse. Ensuite, afin d’analyser leurs activités herbicide et antifongique, nous avons réalisé des tests in/ex vitro de culture de champignons et mauvaises herbes soumises à des traitements contenant différentes concentrations d’huiles essentielles. L’analyse de la composition chimique des huiles a révélé que chaque espèce de pin possède des constituants bien spécifiques mais souvent similaires tels que l’α-pinène qui représente le composé commun. Par ailleurs, divers composés sont présents uniquement chez certaines espèces, tels que le manoyl oxide (25,2%) pour P. caribaea et le (E)-calamanène (15,2%) pour P. coulteri. L’étude de l’activité herbicide de ces huiles vis-à-vis des espèces testées (Sinapis arvensis L., Phalaris canariensis L. et Triticum turgidum L.) a montré un effet inhibiteur considérable sur leur germination et leur croissance. L’étude de l’activité antifongique sur différentes espèces phytopathogènes (Fusarium avenaceum, Fusarium solani, Fusarium oxysporum, Botrytis cinerea et Bipolaris sorokiniana) a révélé que ces huiles inhibent la croissance des champignons, néanmoins cet effet est moins prononcé que l’action herbicide. Ces potentielles activités antifongique et herbicide restent à valider en plein champ ainsi que leur impact sur leur environnement avant de pouvoir suggérer et formuler un bio-pesticide à base d’huiles essentielles de pin.
Mots clés : antifongique / herbicide / huile essentielle / pin.
-
Introduction
De fortes pressions de sélection sont exercées sur les champignons phytopathogènes ainsi que les mauvaises herbes depuis l’utilisation des premiers pesticides. Elles ont été accentuées depuis les cinquante dernières années par leur utilisation massive. De plus, l’application sur les cultures de fongicides et herbicides à cibles identiques favorise largement l’apparition d’espèces résistantes. Les pesticides inefficaces deviennent alors obsolètes, ne connaissent plus de débouchés commerciaux et perdent peu à peu leur homologation. Leur toxicité pour l’homme découverte lors d’études toxicologiques est aussi un facteur qui a favorisé de nombreux retraits de matières actives (Oerke 2006). La recherche continue de nouveaux produits antifongiques et herbicides reste donc une nécessité à laquelle il faut répondre. L’orientation des travaux vers des bio-pesticides semble également porteuse. La stratégie d’utiliser des bio-molécules à partir de substances végétales peut aussi être intéressante. En effet, certaines huiles essentielles sont pourvues d’activités antibiotiques importantes à large spectre (Dayan et al. 1999; Cakir et al. 2004). La perspective de pouvoir contrôler et/ou réduire l’utilisation de produits chimiques toxiques et généralement polluants est attrayante et conduit au développement de nouvelles stratégies et molécules parfois très avantageuses pour la lutte contre les pathogènes et mauvaises herbes des cultures (Kordali et al. 2007). Dans ce contexte, on se propose d’analyser la composition chimique des huiles essentielles de trois espèces de pin (figure 1) : Pinus brutia, Pinus coulteri et Pinus caribaea ; puis d’effectuer une prospection de leur capacité antifongique et herbicide respectivement sur des champignons phytopathogènes et des mauvaises herbes envahissant les espèces cultivées.
|
|
|
Figure 1 : Aspect et taille des cônes de pin à maturité. A: P. caribaea, B: P. brutia et C: P.coulteri. Barre = 3cm. |
2. Matériel et Méthodes
2.1. Récolte des échantillons et extraction des huiles essentielles
Trois espèces de pin ont été considérées au cours de cette étude : Pinus brutia Ten. (1811), Pinus coulteri et Pinus caribaea Mor. (1851). Les feuilles sont prélevées sur des arbres âgés de 20 ans et provenant de l’arboretum de l’INRGREF de la région de Aïn Draham en décembre 2010. Les échantillons ont subi un séchage pendant quinze jours en serre, avant de passer à l’extraction. Cinq échantillons sont prélevés à partir d’une dizaine d’arbres (choisis au hasard et distants au moins de 5 mètres) et stockés en serre, puis mélangés pour homogénéisation et enfin utilisés en trois répétitions au cours de l’extraction. Cette dernière est réalisée par hydrodistillation à l’aide d’un appareil de type Clevenger durant 3 heures à raison de 100 g de matériel végétal pour 500 ml d’eau distillée. Enfin, les huiles essentielles sont récupérées à l’aide d’une seringue, centrifugées afin d’éliminer les traces d’eau et stockées à une température de 4 °C à l’abri de la lumière jusqu’au moment de leur utilisation.
2.2. Détermination des propriétés physico-chimiques des huiles essentielles
Le rendement est exprimé en gramme d’huile essentielle pour 100 grammes de matériel végétal. Etant donné que l’on utilise un matériel végétal sec, on rapporte le rendement à celui du matériel frais en tenant compte de sa teneur en eau. La densité relative de l’huile essentielle correspond au rapport de la masse d’un volume d’huile essentielle à 20 °C à la masse du même volume en eau distillée à 20 °C. L’indice de réfraction est mesuré à l’aide d’un refractomètre à la température ambiante puis ramené à 20 °C par la formule suivante :
I20 = It + 0,00045 (T - 20 °C)
Avec :
I20 : indice à 20 °C ; It : indice à la température ambiante ou de mesure ; T : Température ambiante ou de mesure.
2.3. Analyse chromatographique
L’analyse chromatographique est réalisée à l’aide d’un chromatographe en phase gazeuse (GC-2014 Shimadzu gaz chromatograph), , la température de l’injecteur est 250 °C et celle du détecteur est de 270 °C et la température de la colonne suit le programme suivant : la colonne a une température initiale de 50 °C qui est maintenue pendant 1 minute, puis de 50 °C à 175 °C à raison de 5 °C par minute. La température de 175 °C est maintenue pendant 10 minutes. Ensuite elle passe de 175 °C à 250 °C (15 °C/min). 10 µl d’huile essentielle sont dilués avec 0.1 ml de n-hexane (1 µl injecté). Les composés des huiles essentielles sont identifiés par comparaison des spectres avec une base de données (Adams 2001) et en calculant les indices de rétention. L’identification de molécules pour lesquelles des standards étaient disponibles, a été vérifiée par co-injection et mesure des temps de rétention. La teneur (%) des différents composés identifiés dans une huile essentielle donnée est déterminée par normalisation à 100 %.
2.3. Activité herbicide
Matériel végétal
Trois espèces végétales (Sinapis arvensis L. ou moutarde des champs, Phalaris canariensis L. ou alpiste et Triticum turgidum L. subsp. durum (Desf.) Husn. ou blé dur) ont été utilisées pour évaluer le pouvoir phytotoxique des huiles essentielles, en considérant deux stades de culture, germinatif et adulte. Le choix du blé dur et des mauvaises herbes mono et dicotylédones a été guidé par la volonté d’identifier un effet sélectif.
Méthodologie
L’activité herbicide a été évaluée aux stades germinatif et adulte. Cette étude a été effectuée par la méthode de contact direct (Tworkoski 2002). Dans des boites de Pétri, 10 graines sont mises à germer entre deux papiers filtres en présence de 8 ml de solution d’huile essentielle diluée dans l’eau avec le tween 20 (0.1 %), en utilisant les concentrations suivantes : 0, 2.5, 5, 7.5 et 10 µl/ml. Trois répétitions ont été effectuées pour chaque essai. Pour l’étude de la phytotoxicité des huiles essentielles au stade adulte, l’application de l’huile essentielle se fait par pulvérisation avec différentes concentrations d’huile dans une solution eau+ tween 20 (0.1 %) également. Pour cela, nous avons commencé par la culture de quelques herbes (test au stade germinatif) dans des plaquettes dont les alvéoles sont remplies d’un mélange de tourbe, sable et perlite (1/3 de chaque). Quatre semaines après l’émergence des graines, l’activité herbicide de chaque huile essentielle a été évaluée : un lot témoin pulvérisé avec l’eau distillée et trois lots pulvérisés avec trois concentrations différentes d’huile essentielle (40, 80 et 120 µl/ml). Un jour après pulvérisation, les effets phytotoxiques de l’huile à différentes doses on été mesurés en se référant au témoin. Trois répétitions ont été effectuées pour chaque essai.
Paramètres mesurés
-Mesure des produits de peroxydation
Ce paramètre est étudié au niveau des racines au cours du stade germinatif ; le stade adulte ayant été fortement affecté par une toxicité aigüe, n’a pas été considéré. La peroxydation des lipides est estimée par l’évolution de la teneur en malondialdéhyde (MDA), produit de la dégradation oxydative des acides gras polyinsaturés, selon la méthode décrite par Prasad et al. (1995). L’homogénéisation du tissu végétal dans l’acide trichloracétique 0.1 % à raison de 10ml pour 1 g de tissu est suivie d’une centrifugation pendant 10 min à 10000 g à la température de 4 °C. Au surnageant, est ajouté un volume égal d’acide thiobarbiturique (TBA) 0.5 % dans le TCA 20 %. Le mélange est incubé à 100 °C pendant 30 min. L’absorbance du surnageant, obtenu après centrifugation à 10000 g pendant 5 min, est lue à 532 nm. La densité optique est ensuite corrigée par la soustraction de l’absorbance non spécifique à 600 nm. La teneur en MDA est calculée par la formule suivante DO = ε.C.l en utilisant le coefficient d’extinction molaire du MDA (ε = 155 l. mmol-1. cm-1).
-La teneur en proline
La teneur en proline a été mesurée selon la méthode décrite par Bates et al. (1973). 100 mg de poudre de matériel végétal ont été digérés dans 3 ml d’acide sulfosalicylique (3 %) pendant 30 min à 100 °C suivie d’une centrifugation à 2000 g pendant 5 min à 25 °C. 0.2ml de l’extrait a été ajouté à 0.4 ml d’eau distillée et 2 ml de mélange de réactif (composé de 30 ml d’acide acétique glacial, 20 ml d’eau distillée et 0.5 g de ninhydrine). Les échantillons ont été mis à ébullition pendant 1 heure puis refroidis et extraits avec 6 ml de toluène. L’absorbance de la phase de toluène a été déterminée à 520 nm et la teneur en proline a été calculée à partir d’une courbe standard et exprimé en mg/g MS.
-La teneur en eau (TE)
La TE est déterminée après séchage des feuilles à 70 °C pendant 72 heures selon la formule suivante :
Ce paramètre a servi pour l’expression du rendement en masse sèche. Trois répétitions ont été effectuées pour chaque essai.
-Appréciation de l’intégrité membranaire
L’intégrité membranaire est étudiée au niveau des racines au cours du stade germinatif et au niveau des parties aériennes au stade adulte selon la méthode de Singh et al. (2008). Ce paramètre a été inclus afin d'avoir une indication sur la stabilité de la membrane et la teneur relative en ions. Les racines de graines germées et les feuilles des plantes adultes ont été lavées avec de l'eau distillée et ont été placés dans des flacons fermés contenant 100 ml d'eau distillée et incubées à 25 °C pendant 2 h, ensuite la conductivité électrique C1 de cette solution a été déterminée à l’aide d’un conductimètre. Les échantillons ont été ensuite autoclavés à 120 °C pendant 20 minutes et la conductivité électrique C2 a été déterminée après stabilisation à 25 °C. La fuite d'électrolytes a été définie comme suit: fuite d’électrolytes (%) = (C1/C2) x100. Trois répétitions ont été effectuées pour chaque essai.
2.4. Activité antifongique
L’activité antifongique des huiles essentielles de pin est étudiée par la méthode de contact direct sur milieu PDA (Cakir et al. 2004) sur les souches suivantes : Fusarium avenaceum, Fusarium solani, Fusarium oxysporum, Botrytis cinerea et Bipolaris sorokiniana, champignons phytopathogènes de différentes espèces cultivées. Trois répétitions ont été effectuées pour chaque essai.
2.5. Analyses statistiques
Les valeurs obtenues pour les différents paramètres calculés et mesurés ont fait l’objet d’une analyse de variance (ANOVA) à un facteur en utilisant le logiciel SPSS 17.0. Les moyennes des valeurs annotées d’une même lettre ne sont pas considérées comme différentes selon le test de Student-Newman-Keuls au seuil p ≤ 0.05. Une analyse en composantes principales a été effectuée selon la méthode d’analyse factorielle tenant compte de 10 composés chimiques dont le taux est supérieur à 5 % chez une espèce au moins.
3. Résultats
3.1. Propriétés physico-chimiques et composition chimique des huiles essentielles
Caractérisation physico-chimique des huiles essentielles
Les propriétés physico-chimiques de l’huile essentielle constituent un critère d’authentification et d’analyse de leur qualité, elles sont rapportées au tableau 1. En moyenne, l’indice de réfraction est de 1,48. Les 3 espèces possèdent globalement la même densité et le même indice de réfraction. Toutefois le rendement d’extraction de l’huile essentielle de P. brutia (1,1 %) est nettement supérieur à ceux de P. coulteri (0,85 %) et P. caribaea (0,7 %).
|
Tableau 1 : Propriétés physico-chimiques des huiles essentielles de P. coulteri, P. brutia et P. caribaea. |
||||
|
Espèce |
Rendement (%) |
Densité (g/ml) |
Indice de réfraction |
Couleur |
|
P. coulteri |
0.85±0.1 |
0.90 |
1.49 |
Jaune pâle |
|
P. brutia |
1,1±0.15 |
0.95 |
1.47 |
incolore |
|
P. caribaea |
0.70±0.1 |
0.90 |
1.48 |
Jaune pâle |
Composition chimique des huiles essentielles
Les composés identifiés et leurs pourcentages relatifs sont représentés au tableau 2 selon leur indice de rétention. Bien qu’une différence significative soit observée entre les trois espèces, l’α-pinène reste le composé commun. Pour les huiles de P. coulteri, les analyses chromatographiques nous ont permis d’identifier 45 composés représentant 98,3 % de la totalité, avec une richesse spécifique en monoterpènes hydrocarbonés (29,2 %) et sesquiterpènes hydrocarbonés (55,4 %), alors que les monoterpènes et sesquiterpènes oxygénés sont représentés par de faibles teneurs (6,8 et 5,8 % respectivement). En terme de composés majeurs, les huiles de P. coulteri sont caractérisées par leur richesse en : β-caryophyllène (21,3 %), (E)-calamanène (15,2 %), β-pinène (11,3 %), α-pinène (10,8 %) et α-phellandrène (5,1 %). Les analyses chromatographiques ont révélé la présence de 36 composés représentant 97,8 % de la totalité des huiles essentielles de P. brutia particulièrement riches en monoterpènes hydrocarbonés (52,5 %), monoterpènes oxygénés (16,4 %) et sesquiterpènes hydrocarbonés (16 %). Les composés majeurs de l’huile de cette espèce sont: α-pinène (29,1 %), β-pinène (10,5 %), β-caryophyllène (5,3 %) et β-thujone (4,8 %). L’analyse des huiles essentielles de P. caribaea a révélé 36 composés représentant 98,4 % de la totalité de l’huile. Les monoterpènes hydrocarbonés représentent 26 %, les sesquiterpenes hydrocarbonés sont représentés par 35,1 %, alors qu’une richesse particulière et remarquable de cette espèce en diterpènes oxygénés (25,2 %) rend cette espèce différente de P. coulteri et P. brutia. Les composés majeurs de cette espèce sont : le manoyl oxide représenté par 25,2 %, en effet il s’agit du seul diterpène oxygéné détecté dans cette huile expliquant sa richesse en cette fraction, puis le β-caryophyllène (14,4 %), le limonène (12,1 %),le terpinen-4-ol (6,4 %) et l’α-pinène (6,3 %). L’analyse en composante principale des huiles essentielles de ces espèces nous a permis d’extraire deux composantes représentées par l’axe 1 et l’axe 2 de la carte factorielle sur la figure 2. P. caribaea forme un groupe séparé caractérisé par sa richesse en manoyl oxide, limonène et terpinen-4-ol. Un second groupe formé par P. brutia et P. coulteri également divisible en deux sous groupes, le premier, formé par P. brutia, est caractérisé par sa richesse en α et β-pinène et le second, formé par P. coulteri est caractérisé par sa richesse en α et β-pinène, β-caryophyllène et le(E)-calamanène se démarquant ainsi de P. brutia.
|
Tableau 2 : Composition chimique des huiles essentielles extraites à partir des aiguilles de P. coulteri, P. brutia et P. caribaea.
|
||||||
|
N° |
I.R. |
Composés % |
P. coulteri |
P. caribaea |
P. brutia |
Identification |
|
1 |
926 |
tricyclène |
0±0 |
0,2±0 |
0±0 |
I.R., SM |
|
2 |
939 |
α-pinène |
10,8±0,4 |
6,3±0,3 |
29,1±1,2 |
I.R., SM, Co-inj |
|
3 |
950 |
α-fenchène |
0±0 |
1,7±0,1 |
0,2±0 |
I.R., SM |
|
4 |
954 |
camphène |
0,6±0 |
0±0 |
1,9±0,1 |
I.R., SM |
|
5 |
976 |
β-pinène |
11,3±0,5 |
0±0 |
10,5±1,1 |
I.R., SM, Co-inj |
|
6 |
991 |
β-myrcène |
1±0,1 |
0,2±0,1 |
1,4±0,1 |
I.R., SM |
|
7 |
1007 |
α-phellandrène |
5,1±0,3 |
0,1±0 |
0±0 |
I.R., SM |
|
8 |
1011 |
δ-3-carène |
0±0 |
0±0 |
2,3±0,2 |
I.R., SM |
|
9 |
1021 |
1,8-cinèole |
1,6±0,2 |
0,1±0 |
1,8±0,1 |
I.R., SM, Co-inj |
|
10 |
1026 |
p-cymène |
0±0 |
0±0 |
2,4±0,2 |
I.R., SM |
|
11 |
1031 |
limonène |
0±0 |
12,1±1 |
3,9±0,3 |
I.R., SM, Co-inj |
|
12 |
1037 |
(Z)-β-ocimène |
0,1±0 |
0,2±0,1 |
0,1±0 |
I.R., SM |
|
13 |
1062 |
δ-terpinène |
0,1±0 |
0,1±0 |
0,2±0 |
I.R., SM |
|
14 |
1088 |
α-terpinolène |
0,2±0 |
5±0,3 |
0,5±0,1 |
I.R., SM |
|
15 |
1098 |
linalool |
0,3±0,1 |
2±0,1 |
0±0 |
I.R., SM |
|
16 |
1115 |
β-thujone |
0±0 |
0±0 |
4,8±0,2 |
I.R., SM, Co-inj |
|
17 |
1141 |
(Z)-sabinol |
0,2±0 |
0,1±0 |
2,8±0,3 |
I.R., SM |
|
18 |
1142 |
camphor |
0±0 |
0±0 |
2,5±0,2 |
I.R., SM, Co-inj |
|
19 |
1149 |
bornéol |
0,5±0,1 |
0,1±0 |
0,3±0,1 |
I.R., SM |
|
20 |
1176 |
myrténol |
0±0 |
0±0 |
1,4±0,2 |
I.R., SM |
|
21 |
1179 |
α-terpinèn-4-ol |
0,1±0,1 |
6,4±0,2 |
0,5±0,1 |
I.R., SM |
|
22 |
1185 |
cryptone |
0±0 |
0,3±0,1 |
0±0 |
I.R., SM, Co-inj |
|
23 |
1193 |
dihydrocarvéol |
0,2±0,1 |
0±0 |
0±0 |
I.R., SM |
|
24 |
1196 |
α-terpinéol |
0±0 |
0±0 |
1,3±0,2 |
I.R., SM, Co-inj |
|
25 |
1197 |
méthyl chavicol |
0,2±0 |
0±0 |
0±0 |
I.R., SM |
|
26 |
1198 |
estragole |
2,3±0,3 |
0,1±0 |
0±0 |
I.R., SM |
|
27 |
1205 |
verbénone |
0±0 |
0±0 |
2,3±0,2 |
I.R., SM |
|
28 |
1235 |
méthyl thymol éther |
0,1±0 |
0±0 |
0±0 |
I.R., SM |
|
29 |
1279 |
isobornyl acétate |
0,6±0,1 |
0,1±0 |
1,3±0,2 |
I.R., SM |
|
30 |
1337 |
α-terpényl acétate |
0,8±0,1 |
0±0 |
0,2±0 |
I.R., SM |
|
31 |
1381 |
géranyl acétate |
0±0 |
0,3±0,1 |
0±0 |
I.R., SM |
|
32 |
1387 |
β-cububène |
2,7±0,4 |
0±0 |
0±0 |
I.R., SM |
|
33 |
1388 |
β-bourbonène |
0,2±0,1 |
0±0 |
0,2±0,1 |
I.R., SM |
|
34 |
1390 |
β-élemène |
2,1±0,3 |
0±0 |
0,1±0,1 |
I.R., SM, Co-inj |
|
35 |
1398 |
longifolène |
0,6±0,1 |
0,1±0 |
4,6±0,6 |
I.R., SM |
|
36 |
1403 |
méthyl eugénol |
1,5±0,1 |
0,2±0,1 |
0±0 |
I.R., SM |
|
37 |
1420 |
β-caryophyllène |
21,3±1,1 |
14,4±1,3 |
5,3±0,4 |
I.R., SM, Co-inj |
|
38 |
1441 |
aromadendrène |
0,1±0,1 |
17,2±0,7 |
0,3±0,1 |
I.R., SM |
|
39 |
1448 |
α-humulène |
0,7±0,2 |
0,1±0 |
2,5±0,2 |
I.R., SM, Co-inj |
|
40 |
1462 |
dihydroaromandrène |
0,1±0 |
0±0 |
0±0 |
I.R., SM |
|
41 |
1463 |
canadi,1,4-diène |
0,7±0,2 |
0,2±0 |
0±0 |
I.R., SM |
|
42 |
1477 |
δ-gurjunène |
1,2±0,1 |
0,1±0 |
0±0 |
I.R., SM |
|
43 |
1478 |
germacrène D |
6,2±0,4 |
1,8±0,2 |
0,6±0,1 |
I.R., SM |
|
44 |
1484 |
α-amorphène |
0,2±0,1 |
0,1±0 |
0±0 |
I.R., SM |
|
45 |
1486 |
β-selinène |
1±0,2 |
0,2±0 |
0,1±0 |
I.R., SM |
|
46 |
1495 |
bicyclogermacrène |
0,2±0 |
0,2±0,1 |
0,4±0,1 |
I.R., SM |
|
47 |
1499 |
α-murrolène |
0,4±0,1 |
0±0 |
0±0 |
I.R., SM |
|
48 |
1505 |
α-farnasène |
0,3±0 |
0±0 |
0,1±0 |
I.R., SM |
|
49 |
1508 |
b-bisabolène |
0,1±0,1 |
0,2±0 |
0±0 |
I.R., SM |
|
50 |
1521 |
(E)-calmanène |
15,2±0,4 |
0,1±0 |
0±0 |
I.R., SM |
|
51 |
1524 |
δ-cadinène |
0,1±0 |
0,2±0 |
1,8±0,3 |
I.R., SM |
|
52 |
1559 |
nérolidol |
0,5±0,1 |
0,1±0 |
0±0 |
I.R., SM |
|
53 |
1560 |
β-calacorène |
0,6±0,1 |
0±0 |
0±0 |
I.R., SM |
|
54 |
1576 |
caryophyllène oxide |
0±0 |
0±0 |
3,9±0,2 |
I.R., SM |
|
55 |
1592 |
viridiflorol |
0±0 |
0±0 |
3,8±0,4 |
I.R., SM |
|
56 |
1612 |
tétradecanal |
0,3±0,1 |
0,3±0,1 |
0±0 |
I.R., SM |
|
57 |
1627 |
tau-murrolol |
5,3±0,4 |
2±0,2 |
0±0 |
I.R., SM |
|
58 |
1938 |
cembrène |
0,2±0,1 |
0,2±0 |
0±0 |
I.R., SM |
|
59 |
1993 |
manoyl oxide |
0,3±0,1 |
25,2±3,1 |
0±0 |
I.R., SM |
|
60 |
2044 |
abiétatriène |
0±0 |
0±0 |
2,4±0,3 |
I.R., SM |
|
Identification totale % |
98,3 |
98,4 |
97,8 |
|||
|
Monoterpènes hydrocarbonés % |
29,2 |
26 |
52,5 |
|||
|
Monoterpènes oxygénés % |
6,8 |
9,4 |
16,4 |
|||
|
Sesquiterpènes hydrocarbonés % |
55,4 |
35,1 |
16 |
|||
|
Sesquiterpènes oxygénés % |
5,8 |
2,1 |
7,7 |
|||
|
Diterpènes hydrocarbonés % |
0,2 |
0,2 |
2,4 |
|||
|
Diterpènes oxygénés % |
0,3 |
25,2 |
0 |
|||
|
Autres % |
0,3 |
0,3 |
0 |
|||
|
Les valeurs indiquées représentent une moyenne de 3 répétitions avec leur déviation standard.
|
||||||
|
|
|
Figure 2 : Analyse en composantes principales des huiles essentielles des 3 espèces de pin. α-pinène : alfa_pin ; β-pinène : béta_pin ; α-phellandrène : a_phel ; limonène : lim ; α-terpinolène : terp ; α-terpinèn-4-ol : terpol ; β-caryophyllène : cary ; (E)-calmanène : cal ; manoyl oxide : man ; aromadendrène : arom ; germacrène D: ger. |
3.2. Mesure de l’activité herbicide
3.2.1. Stade germinatif
Effet sur la capacité germinative et la croissance des jeunes plantules
D’après les résultats présentés dans le tableau 3, l’huile essentielle des trois espèces exerce des effets inhibiteurs importants sur la germination des plantes testées. L’activité herbicide est variable en fonction de la dose d’huile essentielle utilisée et de la plante testée. En effet, l’action inhibitrice de l’huile essentielle de P. coulteri sur S. arvensis est plus intense que celles de P. brutia et P. coulteri, et ceci est observable à partir de la dose de 2,5 µl/ml. Dans le cas de P. canariensis, l’inhibition de la germination est pratiquement la même avec les trois huiles. Cette tendance est maintenue dans le cas du blé dur, sauf qu’il n’y a pas une inhibition totale à la dose maximale 10 µl/ml. D’autre part, nous avons remarqué qu’à de faibles doses, l’action de l’huile se traduit par une inhibition partielle de la germination, accompagnée d’un retard de germination et une inhibition de la croissance des parties aériennes et racinaires des plantules (tableaux 4 et 5). L’effet des huiles essentielles sur la vitesse de germination est similaire à celui analysé pour la capacité germinative. Par ailleurs nous avons constaté que S. arvensis et P. canariensis germent plus lentement que T. turgidum. Ainsi, l’huile essentielle des différentes espèces de pin présente un effet inhibiteur sur la capacité germinative et la vitesse de germination des espèces végétales testées ; cet effet est variable selon la dose et l’espèce de pin. L’étude de la croissance de la partie aérienne (tableau 4) nous a permis de constater que S. arvensis est l’adventice la plus sensible, particulièrement vis-à-vis de l’huile essentielle de P. coulteri, alors que P. canariensis montre une plus grande sensibilité vis-à-vis de l’huile de P. caribaea. Le blé dur est le moins affecté par ces traitements, même à la dose de 10 µl/ml, la plante continue à croitre (~2 cm). La même tendance est conservée au niveau de la croissance racinaire des plantes soumises à ces traitements (tableau 5).
|
Tableau 3 : Effet de l’huile essentielle de Pinus coulteri, P. caribaea et P. brutia sur la capacité germinative des différentes plantes (%).
|
||||
|
Espèce végétale |
Dose (µl/ml) |
P. coulteri |
P. caribaea |
P. brutia |
|
0 |
96,6 ± 5,7a |
96,6 ± 5,7a |
96,6 ± 5,7a |
|
|
S. arvensis |
2,5 |
36,6 ± 5,7b |
100,0 ± 0,0a |
86,6 ± 5,7a |
|
5 |
13,3 ± 5,77c |
46,6 ± 5,7b |
56,6 ± 5,7a |
|
|
7,5 |
0,0 ± 0,0d |
26,6 ± 5,7c |
13,3 ± 5,7b |
|
|
10 |
0,0 ± 0,0d |
10,0 ± 0,0d |
10,0 ± 0,0b |
|
|
P. canariensis |
0 |
76,6 ± 5,7a |
73,3 ± 11,5a |
83,3 ± 5,7a |
|
2,5 |
56,6 ± 5,7b |
40,0 ± 10,0b |
46,6 ± 5,7b |
|
|
5 |
26,6 ± 11,5c |
23,3 ± 5,7c |
23,3 ± 5,7c |
|
|
7,5 |
10,0 ± 0,0d |
6,6 ± 5,7d |
10,0 ± 0,0d |
|
|
10 |
0,0 ± 0,0d |
0,0 ± 0,0d |
0,0 ± 0,0e |
|
|
T. turgidum |
0 |
86,6 ± 5,7a |
86,6 ± 5,7a |
86,6 ± 5,7a |
|
2,5 |
36,6 ± 5,7b |
16,6 ± 5,7b |
33,3 ± 5,7b |
|
|
5 |
20,0 ± 0,0c |
16,6 ± 5,7b |
23,3 ± 5,7c |
|
|
7,5 |
10,0 ± 0,0d |
13,3 ± 5,7b |
13,3 ± 5,7d |
|
|
10 |
10,0 ± 0,0d |
10,0 ± 0,0b |
10,0 ± 0,0d |
|
|
Les valeurs des moyennes de la même colonne ayant des lettres différentes sont significativement différentes selon le test de Student-Newman-Keuls (α = 0.05). |
||||
|
Tableau 4 : Effet de l’huile essentielle de P. coulteri, P. caribaea et P. brutia sur la croissance de la partie aérienne des plantes (cm).
|
||||
|
Espèce végétale |
Dose (µl/ml) |
P. coulteri |
P. caribaea |
P. brutia |
|
0 |
5,77 ± 0,68a |
5,76 ± 0,68a |
5,76 ± 0,68a |
|
|
S. arvensis |
2,5 |
2,70 ± 0,60b |
5,83 ± 0,28a |
4,00 ± 0,50b |
|
5 |
2,03 ± 0,40b |
5,56 ± 0,40a |
1,03 ± 1,78b |
|
|
7,5 |
0,00 ± 0,00c |
4,13 ± 0,32b |
2,83 ± 0,28b,c |
|
|
10 |
0,00 ± 0,00c |
3,06 ± 0,40c |
1,43 ± 0,37b |
|
|
P. canariensis |
0 |
9,00 ± 1,00a |
9,00 ± 1,00a |
9,00 ± 1,00a |
|
2,5 |
5,56 ± 0,92b |
6,56 ± 0,51b |
7,43 ± 0,92b |
|
|
5 |
5,10 ± 0,65b |
3,30 ± 0,65c |
6,30 ± 0,75b |
|
|
7,5 |
2,33 ± 0,28c |
1,23 ± 1,07d |
3,60 ± 0,45c |
|
|
10 |
0,00 ± 0,00d |
0,00 ± 0,00d |
0,00 ± 0,00d |
|
|
T. turgidum |
0 |
9,06 ± 0,51a |
9,06± 0,51a |
9,06 ± 0,51a |
|
2,5 |
5,50 ± 0,50b |
5,00 ± 0,86b |
8,33 ± 0,76a |
|
|
5 |
4,66± 0,57b,c |
4,76± 0,25b |
6,83 ± 0,28b |
|
|
7,5 |
3,83 ± 0,76c |
3,26± 0,25c |
4,50 ± 0,50c |
|
|
10 |
2,50 ± 0,50d |
1,90 ± 0,36d |
2,20 ± 0,75d |
|
|
Les valeurs des moyennes de la même colonne ayant des lettres différentes sont significativement différentes selon le test de Student-Newman-Keuls (α = 0.05). |
||||
|
Tableau 5 : Effet de l’huile essentielle de P. coulteri, P. caribaea et P. brutia sur la croissance de la partie racinaire des plantes (cm). |
||||
|
Espèce végétale |
Dose (µl/ml) |
P. coulteri |
P. caribaea |
P. brutia |
|
0 |
7,70 ± 1,05a |
7,70 ± 1,05a |
7,70 ± 105a |
|
|
S. arvensis |
2,5 |
4,93 ± 1,40b |
4,33 ± 0,76a |
6,00 ± 1,32b |
|
5 |
2,26 ± 1,41c |
4,50 ± 0,86a |
3,43 ± 0,40b,c |
|
|
7,5 |
0 ± 0,00d |
1,80 ± 0,26b |
2,13 ± 0,23c |
|
|
10 |
0 ± 0,00d |
1,50 ± 0,50c |
2,43 ± 0,51c |
|
|
P. canariensis |
0 |
6,43 ± 0,60a |
6,43 ± 0,60a |
6,43 ± 0,60a |
|
2,5 |
4,70 ± 0,60b |
4,76 ± 0,68a,b |
6,63 ± 1,26a |
|
|
5 |
2,93 ± 0,40c |
3,66 ± 0,58b |
6,76 ± 0,75a |
|
|
7,5 |
0,83 ± 0,28d |
190 ± 1,76c |
4,60 ± 1,03b |
|
|
10 |
0 ± 0,00e |
0 ± 0,00d |
0 ± 0,00c |
|
|
T. turgidum |
0 |
7,00 ± 0,50a |
6,33 ± 0,76a |
7,00 ± 0,50a |
|
2,5 |
5,50 ± 0,50b |
3,83 ± 0,28b |
5,50 ± 0,50b |
|
|
5 |
3,56 ± 0,51c |
3,03 ± 0,55b |
3,56 ± 0,51c |
|
|
7,5 |
2,23 ± 0,25c |
3,10 ± 0,36b |
2,23 ± 0,25d |
|
|
10 |
1,40 ± 0,52c |
1,66 ± 0,28c |
1,40 ± 0,52d |
|
|
Les valeurs des moyennes de la même colonne ayant des lettres différentes sont significativement différentes selon le test de Student-Newman-Keuls (α = 0.05). |
||||
Effet sur l’intégrité membranaire des tissus
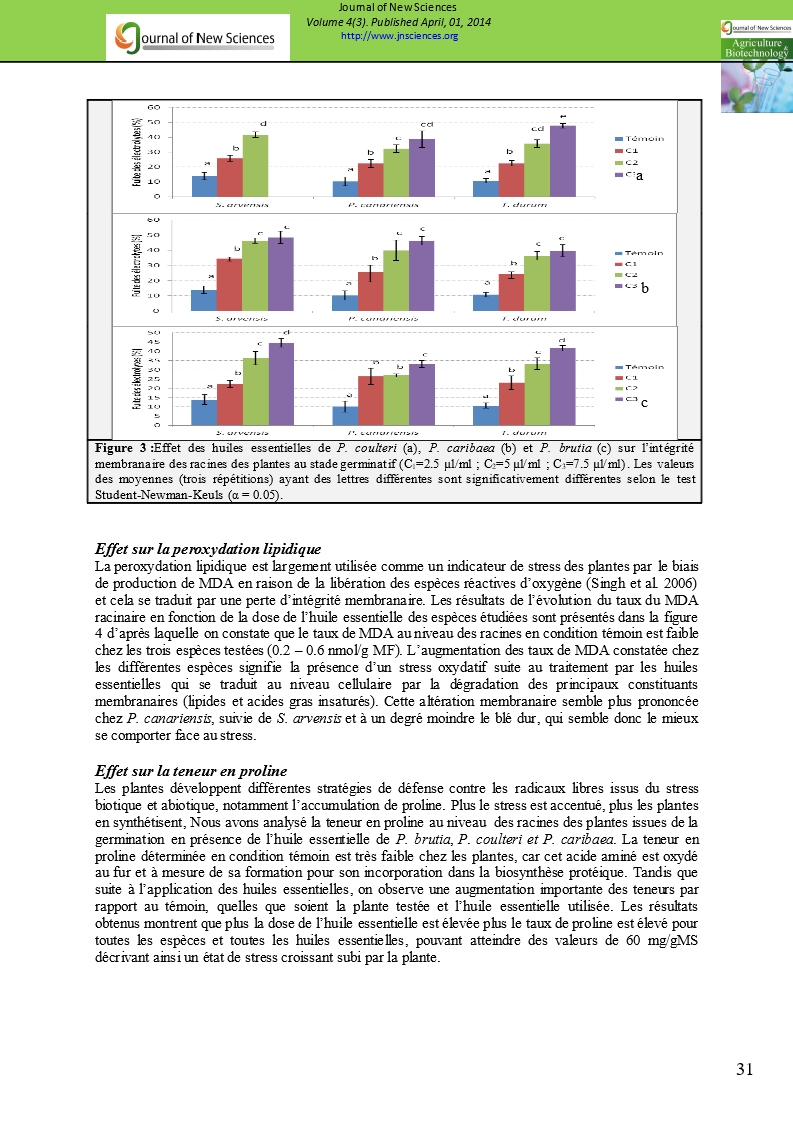
La fuite d’électrolytes est estimée par l’augmentation de la conductivité électrique du milieu externe par rapport au témoin. Les résultats obtenus et illustrés à la figure 3 montrent que l’ampleur de la fuite des électrolytes est proportionnelle à la concentration de l’huile essentielle, phénomène synonyme d’une altération de l’intégrité membranaire. D’après la figure 3a, l’huile essentielle de P. coulteri exerce une action remarquable sur la fuite des électrolytes et par conséquent sur l’intégrité membranaire des tissus principalement chez S. arvensis et dans une moindre mesure chez T. turgidum et P. canariensis. Cet effet est significatif pour la plus faible concentration en huiles essentielles (2,5 µl/ml). Les figures 3b et 3c indiquent également que les huiles essentielles de P. caribaea et brutia entrainent une déstabilisation des membranes. En effet, nous avons enregistré une augmentation graduelle de la fuite d’électrolytes au sein des radicelles des graines germées traitées avec les diverses huiles. Cette augmentation est bien prononcée pour la dose de 7,5 µl/ml pour S. arvensis (au moins 45 %) et P. canariensis (entre 33 et 45 %) traités par les différentes huiles.
|
a
|
|
b
|
|
c
|
|
Figure 3 :Effet des huiles essentielles de P. coulteri (a), P. caribaea (b) et P. brutia (c) sur l’intégrité membranaire des racines des plantes au stade germinatif (C1=2.5 µl/ml ; C2=5 µl/ml ; C3=7.5 µl/ml). Les valeurs des moyennes (trois répétitions) ayant des lettres différentes sont significativement différentes selon le test Student-Newman-Keuls (α = 0.05). |
Effet sur la peroxydation lipidique
La peroxydation lipidique est largement utilisée comme un indicateur de stress des plantes par le biais de production de MDA en raison de la libération des espèces réactives d’oxygène (Singh et al. 2006) et cela se traduit par une perte d’intégrité membranaire. Les résultats de l’évolution du taux du MDA racinaire en fonction de la dose de l’huile essentielle des espèces étudiées sont présentés dans la figure 4 d’après laquelle on constate que le taux de MDA au niveau des racines en condition témoin est faible chez les trois espèces testées (0.2 – 0.6 nmol/g MF). L’augmentation des taux de MDA constatée chez les différentes espèces signifie la présence d’un stress oxydatif suite au traitement par les huiles essentielles qui se traduit au niveau cellulaire par la dégradation des principaux constituants membranaires (lipides et acides gras insaturés). Cette altération membranaire semble plus prononcée chez P. canariensis, suivie de S. arvensis et à un degré moindre le blé dur, qui semble donc le mieux se comporter face au stress.
Effet sur la teneur en proline
Les plantes développent différentes stratégies de défense contre les radicaux libres issus du stress biotique et abiotique, notamment l’accumulation de proline. Plus le stress est accentué, plus les plantes en synthétisent, Nous avons analysé la teneur en proline au niveau des racines des plantes issues de la germination en présence de l’huile essentielle de P. brutia, P. coulteri et P. caribaea. La teneur en proline déterminée en condition témoin est très faible chez les plantes, car cet acide aminé est oxydé au fur et à mesure de sa formation pour son incorporation dans la biosynthèse protéique. Tandis que suite à l’application des huiles essentielles, on observe une augmentation importante des teneurs par rapport au témoin, quelles que soient la plante testée et l’huile essentielle utilisée. Les résultats obtenus montrent que plus la dose de l’huile essentielle est élevée plus le taux de proline est élevé pour toutes les espèces et toutes les huiles essentielles, pouvant atteindre des valeurs de 60 mg/gMS décrivant ainsi un état de stress croissant subi par la plante.
3.2.2. Stade adulte
Un jour après l’application de l’huile essentielle sur les feuilles de S. arvensis, P. canariensis et T. turgidum, des dommages remarquables sur les plantes testées ont été enregistrés. La figure 4 montre que la pulvérisation des plantules par les huiles essentielles entraine le flétrissement et l’étiolement des feuilles. Ce n’est qu’à partir de la dose de 80 µl/ml que nous constatons des effets notables sur les plantules testées et les effets les plus graves ont été engendrés par la dose de 120 µl/ml. Les mécanismes physiologiques impliqués dans cette dégradation et le mode d’action des huiles sont semblables à ceux notés au stade germinatif.
|
120 µl/ml 80 µl/ml 40 µl/ml Témoin
|
|
Figure 4 : Effet de l’huile essentielle de P. coulteri sur les plantes de S. arvensis. Dégradation graduelle de la végétation en fonction de la concentration d’huile essentielle. |
3.3. Analyse de l’activité fongicide
La croissance des champignons est en relation avec la dose d’huile essentielle appliquée. D’après le tableau 6, il apparaît que l’application des huiles essentielles sur les champignons entraine une activité antifongique importante. Cette activité antifongique est plus importante dans le cas de P. coulteri, en effet nous remarquons que la croissance des champignons étudiés est ralentie par rapport au témoin. D’autre part il n’y a pas une grande variabilité de sensibilité des champignons à l’action de l’huile essentielle des espèces de pin étudiées, les taux d’inhibition de la croissance pour les cinq champignons varient entre 61 et 84 %. Toutefois, l’huile essentielle de Pinus coulteri semble la plus efficace à cet égard.
|
Tableau 6 : Effet des huiles essentielles (5 µl/ml) de P. coulteri, P. brutia et P. caribaea sur la croissance (cm) des champignons. |
|||||||
|
Champignon |
Témoin |
P. brutia |
P. coulteri |
P. caribaea |
|||
|
Croissance |
Croissance |
Inhibition (%) |
Croissance |
Inhibition (%) |
Croissance |
Inhibition (%) |
|
|
F. oxysporum |
8,2 ± 0,3 |
2,9 ± 0,1 |
63,9 ± 2,1b |
2,3 ± 0,1 |
71,9 ± 0,7a |
3,2 ± 0,1 |
60,9 ± 0,4c |
|
F. solani |
7,6 ± 0,3 |
2,3 ± 0,8 |
69,0 ± 11,6a |
1,8 ± 0,1 |
76,4 ± 2,9a |
2,6 ± 0,1 |
65,3 ± 2,5b |
|
F. avenaceum |
6,1 ± 0,2 |
2,2 ± 0,1 |
64,2 ± 3,5b |
1,1 ± 0,2 |
81,3 ± 2,8a |
2,0 ± 0,1 |
67,4 ± 3,4b |
|
B. sorokiniana |
6,1 ± 0,3 |
1,5 ± 0,3 |
74,9 ± 4,3c |
1,0 ± 0,1 |
83,8 ± 1,4a |
1,2 ± 0,1 |
80,5 ± 1,2b |
|
B. cinerea |
8,3 ± 0,3 |
1,8 ± 0,1 |
70,1 ± 7,5ab |
2,4 ± 0,1 |
71,3 ± 0,5b |
2,1 ± 0,1 |
75,4 ± 0,2a |
|
Les valeurs des moyennes de la même ligne ayant des lettres différentes sont significativement différentes selon le test de Student-Newman-Keuls (α = 0.05). |
|||||||
4. Discussion
Les résultats relatifs à l’étude des caractéristiques physico-chimiques des huiles essentielles de 3 espèces de pin : Pinus brutia, Pinus coulteri et Pinus caribaea, ainsi qu’à la prospection de leur capacité antifongique et herbicide ont permis de mettre en valeur des propriétés et activités biologiques intéressantes. Les propriétés physico-chimiques des huiles essentielles des différentes espèces sont approximativement les mêmes, sauf que le rendement d’extraction de P. brutia est nettement supérieur aux autres. Chaque espèce de pin possède une huile essentielle dont la composition chimique est bien spécifique et particulière. D’autre part, certains composés sont présents de façon exclusive chez certaines espèces, et contribuent à les démarquer les unes des autres. L’analyse de l’activité biologique de ces huiles a révélé une forte activité phytotoxique contre les mauvaises herbes testées et à moindre degré contre le blé dur cultivé. Ces espèces n’ont pas affiché la même sensibilité, S. arvensis étant la plus sensible aux différentes huiles essentielles ; alors que l’huile essentielle de Pinus coulteri s’est avérée la plus efficiente. L’action herbicide de ces huiles a été mise en valeur au cours des stades germinatif et adulte des plants ; par ailleurs, les deux parties racinaire et aérienne de la plante sont affectées par les huiles essentielles. Aucune sélectivité d’espèces mono/dicotylédones n’a pu être clairement distinguée, excepté une plus grande sensibilité des mauvaises herbes par rapport au blé dur au stade germinatif face au traitement par les huiles essentielles, préconisant ainsi leur utilisant à un stade précoce. Les activités herbicides des huiles essentielles ainsi que leurs composés purs ont été reportés dans la littérature, en effet l’action des huiles essentielles se traduit par une inhibition de la germination et la croissance des parties aériennes et racinaires. L’activité herbicide des huiles essentielles de certaines espèces de pin a été étudiée, la majorité des études a prouvé que les huiles essentielles de ces espèces sont pourvues d’un potentiel herbicide notamment pour l’espèce P. pinea, P. patula et P. halepensis (Amri et al. 2011; 2012; 2013). Cette forte action herbicide des huiles essentielles de pin, tant au stade germinatif qu’au stade adulte, serait due à leurs compositions complexes, en particulier la présence des monoterpènes tel que l’α-pinène. Ces derniers sont responsables de l’altération de l'intégrité des membranes cellulaires, particulièrement via la dégradation peroxydative des lipides membranaires (Singh et al. 2006). L’inhibition de germination, de croissance et l’altération membranaire sont reliées aux concentrations croissantes d’huiles essentielles et par conséquent indicatrices du niveau de stress perçu. Dans cette étude, nous avons choisi d’étudier l’activité herbicide des huiles essentielles sur deux adventices : une plante monocotylédone (Phalaris canariensis) et une plante dicotylédone (Sinapis arvensis). Et afin de rechercher une éventuelle sélectivité d’action, l’étude de l’effet de l’huile essentielle a été également menée sur une plante cultivée : le blé dur (Triticum turgidum). Ainsi, l’analyse des résultats obtenus montre que l’activité herbicide des huiles essentielles affecte à la fois la germination des graines mais aussi la croissance des parties aériennes et racinaires. L'effet phytotoxique de ces huiles essentielles sur la croissance des plantules dépend de la plante testée et de la dose appliquée. L’activité herbicide et les effets phytotoxiques issus des huiles essentielles des plantes ont été déjà rapportés par plusieurs auteurs et pour différentes espèces (Tworkoski 2002; Kordali et al. 2009). Cependant, l’identification de telles propriétés pour les espèces auxquelles nous nous sommes intéressées est pour la première fois décrite. L’activité biologique observée est généralement attribuée aux composés majeurs sans exclure la possibilité d’interactions avec d’autres composés (cas d’antagonisme, de synergisme et d’addition des effets) (Salamci et al. 2007). Les observations faites dans la présente étude sont en accord avec des travaux antérieurs qui ont signalé que les huiles essentielles et leurs terpènes constitutifs empêchent la germination et la croissance des plantes (Tworkoski 2002; Kaur et al. 2010). Singh et al. (2005) ont observé que l'huile essentielle d’Eucalyptus citriodora à des concentrations allant de 5 à 75 μl/ml a provoqué une fuite d'électrolytes grave des plantes Parthenium hysterophorus, ce qui a induit l’altération de l'intégrité des membranes cellulaires. Ainsi, il semblerait que l’effet inhibiteur de la croissance des plantules par l’huile essentielle des 3 espèces de pin serait dû à une désorganisation des structures membranaires et par conséquent à l’arrêt de croissance et à la mort cellulaires. Ces résultats sont en accord avec ceux obtenus par Singh (2006) qui a montré que l’huile essentielle exerce son action par l’inhibition de la croissance racinaire à travers une induction de la peroxydation lipidique au niveau des racines. Cette limitation de croissance pourrait se faire à plusieurs niveaux : diminution de la respiration mitochondriale par les monoterpènes (Abrahim et al. 2000; Singh et al. 2006) ou diminution de la photosynthèse par des sesquiterpènes (Dayan et al. 1999; Paudel and Gupta 2008). En outre, il a récemment été proposé que les monoterpènes oxygénés soient potentiellement utilisés comme bio-herbicides (Kordali et al. 2007). Les huiles essentielles, généralement de caractère apolaire donc lipophile, sont capables de pénétrer à partir de la membrane à travers des pores. Ces pores, sont le résultat des dommages causés au sein de la membrane suite à la perturbation de l’intégrité membranaire (Koitabashi et al. 1997). Foyer et al. (1997) ont montré que différentes espèces réactives à l’oxygène sont produites comme une réponse au stress environnemental. De même, les résultats obtenus par Kaur et al. (2010) montrent que l’activité des huiles essentielles au niveau des feuilles se traduit par augmentation de la peroxydation lipidique ce qui explique la perte de l’intégrité membranaire. Les monoterpènes exercent un effet inhibiteur sur la croissance foliaire et provoquent un stress oxydatif qui se traduit par la production de malondialdéhyde (Zunino and Zygadlo 2004; Singh et al. 2006). D’autre part, il a été démontré que le contact des plantules avec l’α-pinène et d’autres monoterpènes engendre une altération de l’intégrité membranaire, une augmentation des teneurs en proline, en malondialdéhyde et en peroxyde d’hydrogène indiquant la perte des fonctions cellulaires (Singh et al. 2006). Les huiles essentielles des trois espèces de pin ont inhibé significativement la croissance des champignons testés, ces résultats sont en accord avec la littérature, en particulier avec les études menées sur les activités antifongiques d’espèces de pin (Amri et al. 2011; 2012; 2013). Chutia et al. (2009) ont cité que les deux monoterpenes α-pinène et limonène possèdent une activité antifongique importante contre Verticillium fungicola et Trichoderma harzianum. Par ailleurs, Changa et al. (2008) ont montré que l’activité antifongique des sesquiterpènes est supérieure à celle des monoterpènes. Le mode d’action des huiles essentielles a été élucidé par plusieurs études surtout pour les monoterpènes hydrocarbonés, qui sont des composés apolaires doués d’un grand pouvoir pénétrant et qui sont capables de traverser des membranes cellulaires en altérant leurs fonctions cellulaires notamment la pompe à protons ATPase et aboutir à la mort du champignon (Cristani et al., 2007). On conclue alors que l’activité antifongique de ces huiles essentielles est due à la présence à la fois de sesquiterpènes et monoterpènes et à la synergie entre ses composants. La valorisation de ces résultats en plein champ constitue une perspective alléchante et prometteuse ; certes, l’application et l’exploitation de ces caractéristiques et propriétés susmentionnées est tributaire de l’absence d’effets indésirables vis-à-vis de la faune du sol et du respect de l’environnement.
5. Références
Abrahim D, Braguini WL, Kelmer-Bracht Ana M., Ishii-Iwamoto Emy L (2000) Effects of four monoterpenes on germination, primary root growth, and mitochondrial respiration of maize. J Chem Ecol, 26: 611-624.
Adams RP (2001) Identification of Essential Oil Components by Gas Chromatography Quadrupole Mass Spectrometry. Allured, Carol Stream,IL, USA, pp. 455.
Amri I, Gargouri S, Hamrouni L, Hanana M, Fezzani T, Jamoussi B (2012) Chemical composition, phytotoxic and antifungal activities of Pinus pinea essential oil. J Pest Sci, 85: 199-207.
Amri I, Hamrouni L, Gargouri S, Hanana M, Mahfoudhi M, Fezzani T, Ferjani E, Jamoussi B (2011) Chemical composition and biological activities of essential oils of Pinus patula. Nat Prod Commun, 6: 1531-1536.
Amri I, Hamrouni L, Hanana M, Gargouri S, Fezzani T, Jamoussi B (2013) Chemical composition, physico-chemical properties, antifungal and herbicidal activities of Pinus halepensis Miller essential oils. Biological Agriculture & Horticulture, DOI:10.1080/01448765.2013.764486.
Cakir A, Kordali S, Zengin H, Izumi S, Hirata T (2004) Composition and antifungal activity of essential oils isolated from Hypericum hyssopifolium and Hypericum heterophyllum. Flavour Fragrance, 19 : 62-68.
Changa HT, Cheng YH, Wua CL, Chang ST, Tun-Tschu CY (2008) Antifungal activity of essential oil and its constituents from Calocedrus macrolepis var. formosana Florin leaf against plant pathogenic fungi. Biores Technol, 99: 6266-6270.
Chutia M, Deka Bhuyan P, Pathak MG, Sarma TC, Boruah P (2009) Antifungalactivity and chemical composition of Citrus reticulata Blanco essential oil against phytopathogens from North East India. Food Sci Tech, 42 : 777-780.
Cristani M, Arrigo M, Mandalari G, Castelli F, Sarpietro MG, Micieli D, Venuti V, Bisignano G, Saija A, Trombetta D (2007) Interaction of four monoterpenes contained in essential oils with model membranes: implications for their antibacterial activity. J Agric Food Chem, 55: 6300-6308.
Dayan FE, Hernandez A, Allen SN, Moraes RM, Vroman JA, Avery MA, Dukes SO (1999) Comparative phytotoxicity of artemisin in and several sesquiterpenes analogues. Phytochem, 50: 15-24.
Kaur S, Harminder Pal S, Sunil M, Rani B, Kohli Ravinder K (2010) Phytotoxic effects of volatile oil from Artemisia scoparia against weeds and its possible use as a bioherbicide. Ind Crops Prod, 32: 54-61.
Koitabashi R, Suzuki T, Kawazu T, Saka A, Kuroiwa H, Kuroiwa T (1997) 1.8-Cineole inhibits roots growth and DNA synthesis in the root apical meristem of Brassica campestris L. J Plant Res, 110: 1-6.
Kordali S, Cakir A, Akcin TA, Mete E, Akcin A, Aydin T, Kilic H (2009) Antifungal and herbicidal properties of essential oils and n-hexane extracts of Achillea gypsicola Hub-Mor. and Achillea biebersteinii Afan. (Asteraceae). Ind Crops Prod, 29: 562-570.
Oerke EC (2006) Crop losses to pests. J Ag Sci, 144: 31-43.
Paudel VR, Gupta VNP (2008) Effect of some essential oils on seed germination and seedling length of Parthenium hysterophorous L. Ecoprint: an International Journal of Ecology, 15: 69-73.
Salamci E, kordali S, Kotan R, Cakir A Kaya Y (2007) Chemical compositions, antimicrobial and herbicidal effects of essential oils isolated from Turkish Tanacetum aucheranum and Tanacetum chiliophyllum var. chiliophyllum. Biochem Syst Ecol, 35: 569-581.
Singh HP, Batish DR, Setia N, Kohli RK (2005) Herbicidal activity of volatile essential oils from Eucalyptus citriodora against Parthenium hysterophorus. Ann Appl Biol, 146: 89-94.
Singh HP, Batish DR, Kaur S, Arora K, Kohli RK (2006) Pinene inhibits growth and induces oxidative stress in roots. Ann Bot, 98: 1261-1269.
Singh HP, Kaur S, Mittal S, Batish DR, Kohli RK (2008) Phytotoxicity of major constituents of volatile oil from leaves of Artemisia scoparia. Waldst & Kit. Z. Naturforsch, 63: 663-666.
Tworkoski T (2002) Herbicide effects of essential oils. Weed Sci, 50: 425-431.
Zunino MP, Zygadlo JA (2004) Effect of monoterpenes on lipid oxidation in maize. Planta, 219: 303-309.

